 n
n
第一节 硫及其化合物
第1课时 硫和二氧化硫
[核心素养发展目标] 1.能从物质类别和硫元素化合价的角度认识硫和二氧化硫的性质,强化“证据推理与模型认知”能力的发展。2.了解二氧化硫与水反应的可逆性、二氧化硫的漂白性及其与氯气漂白原理的不同。
一、硫
1.硫在周期表中的位置、原子结构和主要化合价
画出原子结构示意图:,确定硫元素位置在第三周期、第ⅥA族,其主要化合价:-2、0、+4、+6。
思考1 在富含氧气的地表附近找到的含硫化合物中,硫常常为+4价或+6价,而氧为-2价,为什么?
提示硫与同主族的氧元素相比,硫元素的原子多一个电子层,得电子能力相对较弱,而失电子能力则相对较强。
2.硫
(1)物理性质
硫(俗称硫黄)是一种黄色晶体,质脆,易研成粉末。硫难溶于水,微溶于酒精,易溶于二硫化碳(CS2)。硫有多种同素异形体,如正交硫和斜方硫。
(2)化学性质
从物质属类及元素价态变化两个角度来理解硫的化学性质。
思考2 分析Fe、Cu与S、Cl2反应后呈现的价态,结合S、Cl的原子结构和元素周期律的相关知识思考氯气、硫与金属反应的相似性和差异性?
提示氯气、硫与金属反应均做氧化剂,氯气的氧化性强于硫,氯气能将变价金属氧化成高价态,硫能将变价金属氧化成低价态。
思考3 Cl、S具有一定的相似性,类比Cl2与NaOH溶液的反应,S与NaOH溶液是否反应呢?试着写出S与NaOH溶液加热时反应的化学方程式。
提示能发生反应;类比Cl2,根据氧化还原规律,S与NaOH发生歧化反应:3S+6NaOH2Na2S+Na2SO3+3H2O。
1.判断正误
(1)要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤( )
(2)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )
(3)单质硫在纯氧中燃烧,其氧化产物为SO3( )
(4)硫是一种非金属单质,与其他单质反应,只能做氧化剂( )
答案 (1)× (2)√ (3)× (4)×
2.下列化合物能用相应的单质直接化合制得的是(填序号)。
①CuS ②FeS ③HCl ④SO2⑤SO3⑥FeCl2⑦CuCl2⑧Cu2S
答案②③④⑦⑧
探索硫的应用
(1)汞有毒,实验室里不慎洒落汞(或打破水银温度计),可撒上硫粉进行处理,其化学方程式为Hg+S===HgS。
(2)利用Ag和S的反应可以鉴别出真假银:用布条沾上少量硫黄粉末在待鉴别的器皿表面用力摩擦,若摩擦处出现黑斑说明是真银,其化学方程式为2Ag+S===Ag2S。
二、二氧化硫
1.物理性质
二氧化硫是一种无色、有刺激性气味的有毒气体,密度比空气的大,易溶于水,通常情况下,1体积的水可以溶解约40体积的二氧化硫。
2.SO2的化学性质——多重性
(1)研究角度一:物质类别的角度——酸性氧化物的通性
①与水反应
实验操作 | a. b.用pH试纸测溶液的pH |
实验现象 | a.试管中液面上升 b.pH试纸呈红色 |
结论:SO2溶于水时可与水反应生成亚硫酸(H2SO3),化学方程式为SO2+H2O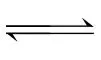 H2SO3;亚硫酸不稳定,容易分解生成SO2和H2O。
H2SO3;亚硫酸不稳定,容易分解生成SO2和H2O。
②可逆反应
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应,化学方程式中用“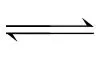 ”而不用“===”。如:Cl2+H2OHCl+HClO。
”而不用“===”。如:Cl2+H2OHCl+HClO。
思考1 SO2为酸性氧化物,可以与水、碱或碱性氧化物反应。
(1)少量SO2通入澄清石灰水中,其离子方程式为SO2+Ca2++2OH-===CaSO3↓+H2O。
(2)足量SO2通入澄清石灰水中,其离子方程式为SO2+OH-===HS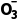 。
。
(3)SO2与CaO反应,其化学方程式为SO2+CaO===CaSO3。
(2)研究角度二:元素化合价角度——氧化性与还原性
(3)研究角度三:特殊性的角度——漂白性
实验现象:振荡后溶液红色褪去,再加热溶液恢复红色。
结论:二氧化硫具有漂白作用,是由于它能与某些有色物质生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
思考2 (1)SO2通入石蕊溶液,溶液。
答案变红
(2)SO2能使溴水、酸性KMnO4溶液褪色,体现其性。
答案还原
3.SO2的用途
(1)漂白纸浆、毛、丝等。
(2)用于杀菌消毒,还是一种食品添加剂。
思考3 SO2在适当的温度并有催化剂存在的条件下,可以被氧气氧化生成SO3。已知SO3的熔点为16.8℃,沸点为44.8℃,也是一种酸性氧化物。思考并回答下列问题:
(1)标准状况下,22.4LSO3所含O原子的数目是3NA吗?为什么?
(2)试分别写出SO3与H2O、CaO、Ca(OH)2反应的化学方程式。
提示(1)不是,因为标准状况下SO3是固态,22.4LSO3不是1mol。
(2)SO3+H2O===H2SO4;
SO3+CaO===CaSO4;
SO3+Ca(OH)2===CaSO4+H2O。
1.判断正误
(1)SO2的水溶液中存在SO2、H2SO3的原因是SO2与H2O的反应为可逆反应( )
(2)SO2可使溴水褪色,是因为SO2有漂白性( )
(3)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( )
(4)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2( )
(5)SO2通入紫色石蕊溶液中先变红色后褪色( )
答案 (1)√ (2)× (3)× (4)× (5)×
2.(2024·湖南常德高一期中)2024年5月24日,印尼塞梅鲁火山经历了六次连续喷发,产生大量SO2进入大气。下列有关SO2的说法错误的是( )
A.将SO2通入滴有酚酞的NaOH溶液中可验证其漂白性
B.SO2能使品红和溴水褪色,原理不同
C.可用酸化的KMnO4溶液来鉴别CO2和SO2两种气体
D.葡萄酒中添加适量的SO2可起到抗氧化的作用
答案 A
解析 SO2是酸性氧化物,可与NaOH反应,使滴有酚酞的溶液红色褪去,与其漂白性无关,故选A。
3.我们已经学习了许多具有漂白性的物质。
(1)请列举你知道的常见的漂白剂:。
答案 活性炭、过氧化氢、过氧化钠、氯水、次氯酸、次氯酸盐、臭氧、二氧化硫
(2)氯水和二氧化硫的水溶液都有漂白性,若将二者混合,漂白性会增强吗?(填“会”或“不会”),并说明原因:
。
答案 不会 若将等物质的量的氯气和二氧化硫气体混合,在溶液中发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力
常见漂白剂的漂白原理及特点
漂白剂 | 漂白原理 | 特点 |
氯水(HClO)、Ca(ClO)2、H2O2 | 利用物质的氧化性氧化有色物质而使之失去原有的颜色 | 不可逆,褪色后不能恢复原来的颜色 |
SO2 | 与有色物质结合生成不稳定的无色物质 | 可逆,在一定条件下又能恢复原来的颜色 |
活性炭 | 具有较大的比表面积,可以吸附有色物质而使之失去原有的颜色 | 可重复使用 |
1.(2024·广东清远高一段考)中国中医用药讲究十八反和十八畏,其中有“硫黄原是火中精,朴硝一见便相争”,硫黄即硫单质。下列说法不正确的是( )
A.硫黄是一种黄色晶体,易研成粉末
B.少量的硫与铜反应可生成Cu2S
C.试管内壁上的硫黄可用CS2清洗
D.SO2具有强氧化性,可用于漂白纸浆
答案 D
解析 SO2具有弱氧化性,其可用于漂白纸浆,是因为SO2可与有色物质结合生成无色物质,故选D。
2.(2024·山东临沂高一段考)下列物质能与SO2气体反应,但无沉淀产生的是( )
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3溶液 ⑤稀硫酸 ⑥Na2SO4溶液 ⑦Na2SO3溶液
A.只有①B.①④⑤
C.④⑥⑦D.①④⑦
答案 D
3.将SO2分别通入下列五种溶液中:
(1)试管①中的实验现象:酸性KMnO4溶液,证明SO2具有性。
(2)试管②中的实验现象:溶液,证明SO2具有性。
(3)试管③中的实验现象:溶液,写出该反应的离子方程式:。
(4)试管④中能产生沉淀,该沉淀是。
(5)试管⑤中能产生白色沉淀,该沉淀是。
答案 (1)褪色 还原 (2)褪色 漂白
(3)褪色 SO2+2OH-===S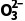 +H2O(或SO2+OH-===HS
+H2O(或SO2+OH-===HS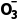 ) (4)白色 BaSO3 (5)BaSO4
) (4)白色 BaSO3 (5)BaSO4
课时对点练[分值:100分]
(选择题1~12题,每小题6分,共72分)
题组一硫单质的性质
1.(2024·河北高一段考)据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫黄)能化金银钢铁,奇物”。下列物质不能由硫与相应单质直接化合得到的是( )
A.H2S B.Ag2S C.CuS D.FeS
答案 C
解析 S氧化性较弱,与Cu反应生成硫化亚铜,故选C。
2.下列关于单质硫的叙述:①通常状况下为黄色晶体;②不溶于水、易溶于酒精和CS2;③氧化性比氯气弱;④只能被还原不能被氧化;⑤医药上用来制作硫黄软膏,治疗某些皮肤病;⑥硫有许多同素异形体,如正交硫和斜方硫。其中正确的是( )
A.①②③⑤B.②③⑤⑥
C.③④⑤⑥D.①③⑤⑥
答案 D

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享