

第2课时 电化学计算模型 多池、多室装置
[核心素养发展目标] 1.掌握电子守恒规律在电化学中的应用。2.掌握多池连接装置的形式及分析思路。3.了解离子交换膜的类型及其作用。
一、电化学计算模型
1.电化学常涉及的计算问题
原电池和电解池的计算常涉及两极产物定量计算,电路中转移电子数的计算、溶液pH的计算、电解前后电极或电极区质量的差值计算等。
2.电化学计算模型

1.500 mL KCl和Cu(NO3)2的混合溶液中c(Cu2+)=0.2 mol·L-1,用石墨作电极电解此溶液,通电一段时间后,两电极均收集到5.6 L(标准状况下)气体,假设电解后溶液的体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Cl-)=0.3 mol·L-1
B.上述电解过程中共转移0.5 mol电子
C.电解得到的无色气体与有色气体的体积比为3∶7
D.阳极收集到的气体为Cl2和O2
2.把两支惰性电极插入500 mL硝酸银溶液中,通电电解。当电解质溶液中c(H+)从10-6 mol·L-1变为10-3 mol·L-1时(设电解时阴极没有氢气析出,且电解质溶液在电解前后体积变化可以忽略),电极上应析出银的质量是( )
A.27 mgB.54 mg
C.108 mgD.216 mg
3.(2023·重庆南开中学高二期中)光电池在光照条件下可产生电流,如图装置可以实现光能源的充分利用,双极膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是( )
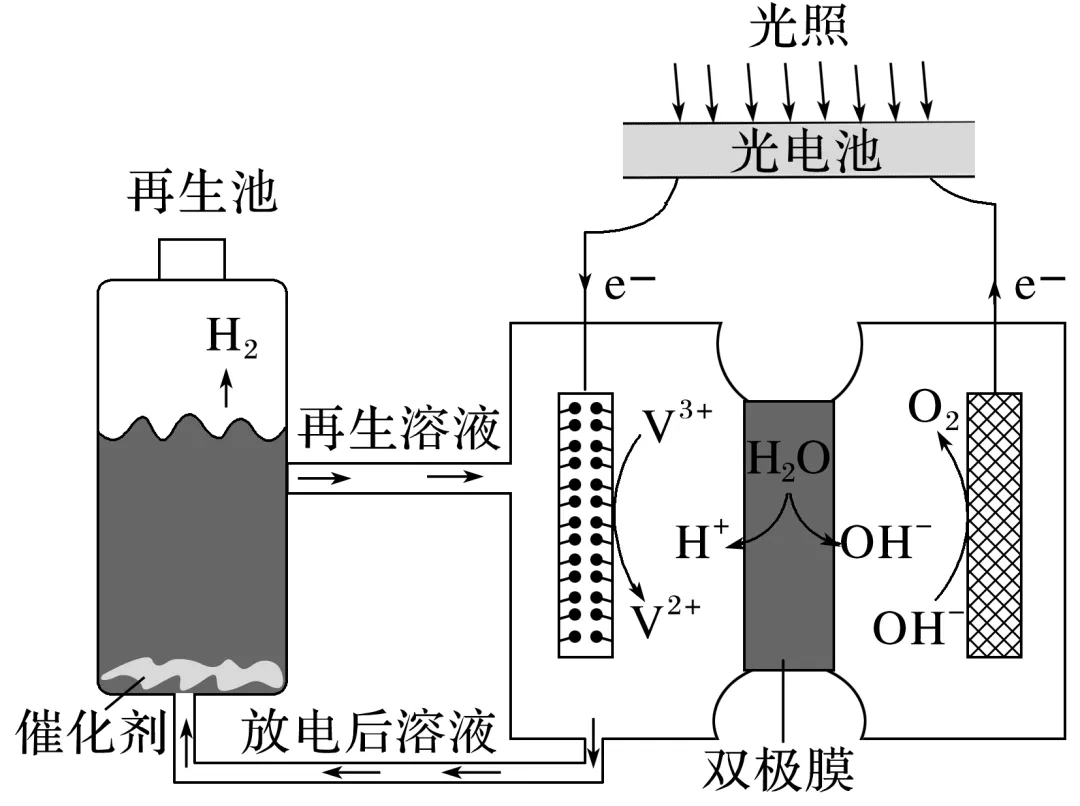
A.该装置可利用光能实现水的分解
B.光照过程中阴极区溶液的pH变小
C.再生池中的反应为2V2++2H+催化剂,2V3++H2↑
D.电路中每有2 mol电子通过,阳极区溶液质量增加2 g
二、多池装置
1.一池两用
用如图所示装置进行实验:
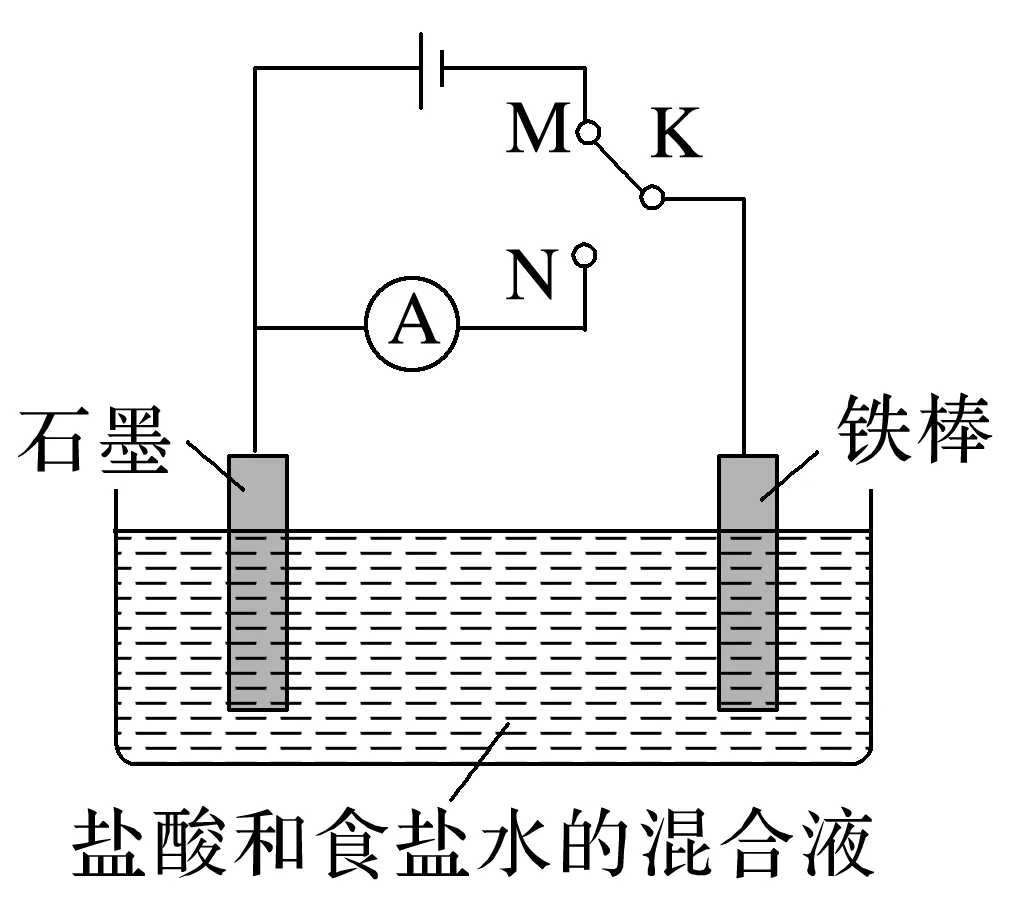
(1)若开始时K与N连接,则构成________,铁棒上发生的电极反应式为________________________________________________________________________;石墨电极产生的现象为____________________________________________________。
(2)若开始时K与M连接,则构成________,铁棒上发生的电极反应式为_________________;石墨电极产生的现象为_________________,一段时间后,溶液的pH________。
(3)若用铝条和镁条分别代替图中的石墨和铁棒电极,电解质溶液为氢氧化钠溶液,请写出原电池负极的电极反应式:_________________________________________________________。
2.多池串联
如图所示装置:
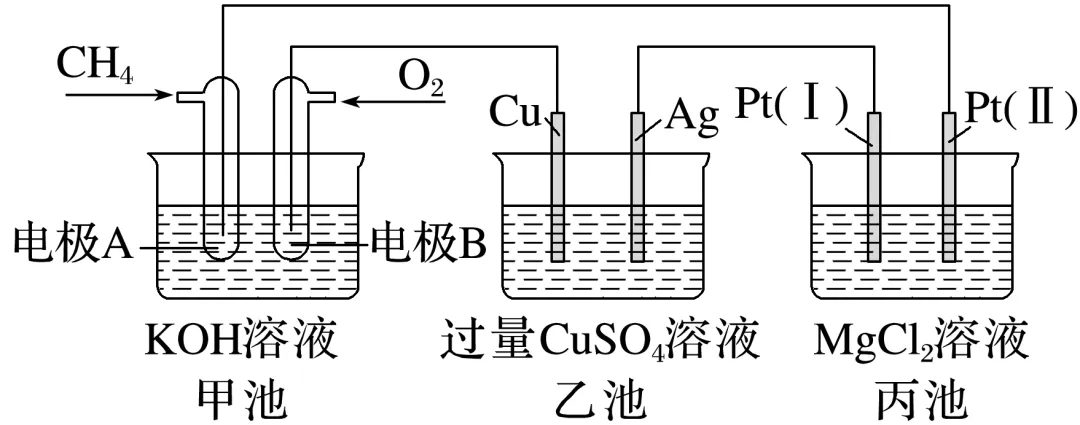
回答下列问题:
(1)甲池是______,乙池是将________能转化为______能的装置。
(2)写出甲、乙、丙池中各电极的电极名称和电极反应式。
_______________________________________________________________________________
_______________________________________________________________________________
3.多池装置的解题模型
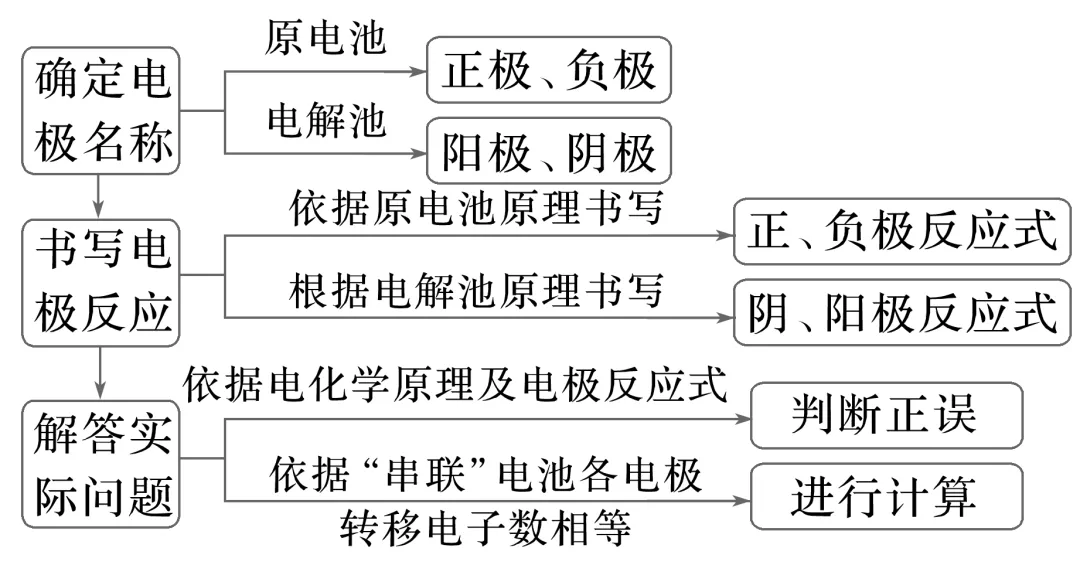

1.用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:①工作一段时间后A烧杯的pH上升,B烧杯的pH下降;②b、c两极上反应的离子的物质的量相等,应选择的电解质溶液是( )
A.A烧杯NaOH溶液;B烧杯CuSO4溶液
B.A烧杯AgNO3溶液;B烧杯CuCl2溶液
C.A烧杯Na2SO4溶液;B烧杯AgNO3溶液
D.A烧杯NaCl溶液;B烧杯AgNO3溶液
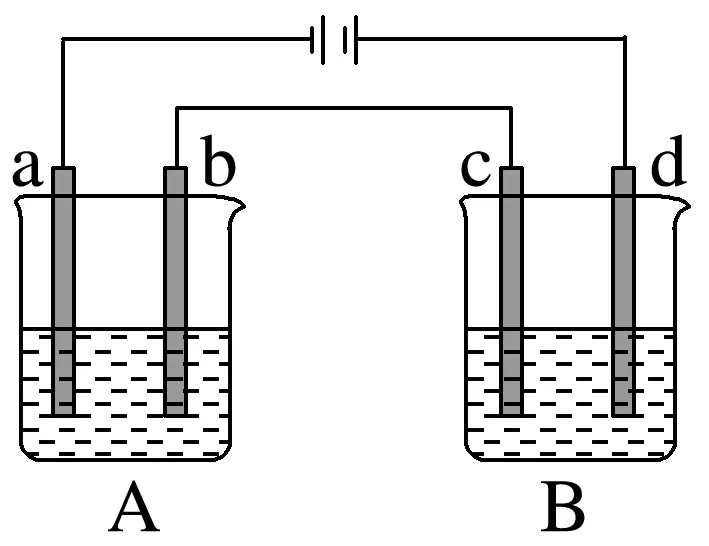
2.某兴趣小组设计如图所示实验装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),闭合S1一段时间后,两极均有气泡产生,Cu电极一侧液面比C电极一侧的低;断开S1,闭合S2,电流表指针发生偏转。下列叙述正确的是( )
A.闭合S1时,Cu电极产生气泡的原因为2Cl--2e-===Cl2↑
B.闭合S1时,若铜电极接直流电源的正极,两极均有气泡产生
C.断开S1、闭合S2时,C电极作负极
D.断开S1、闭合S2时,Cu电极上发生反应:H2-2e-+2OH-===2H2O
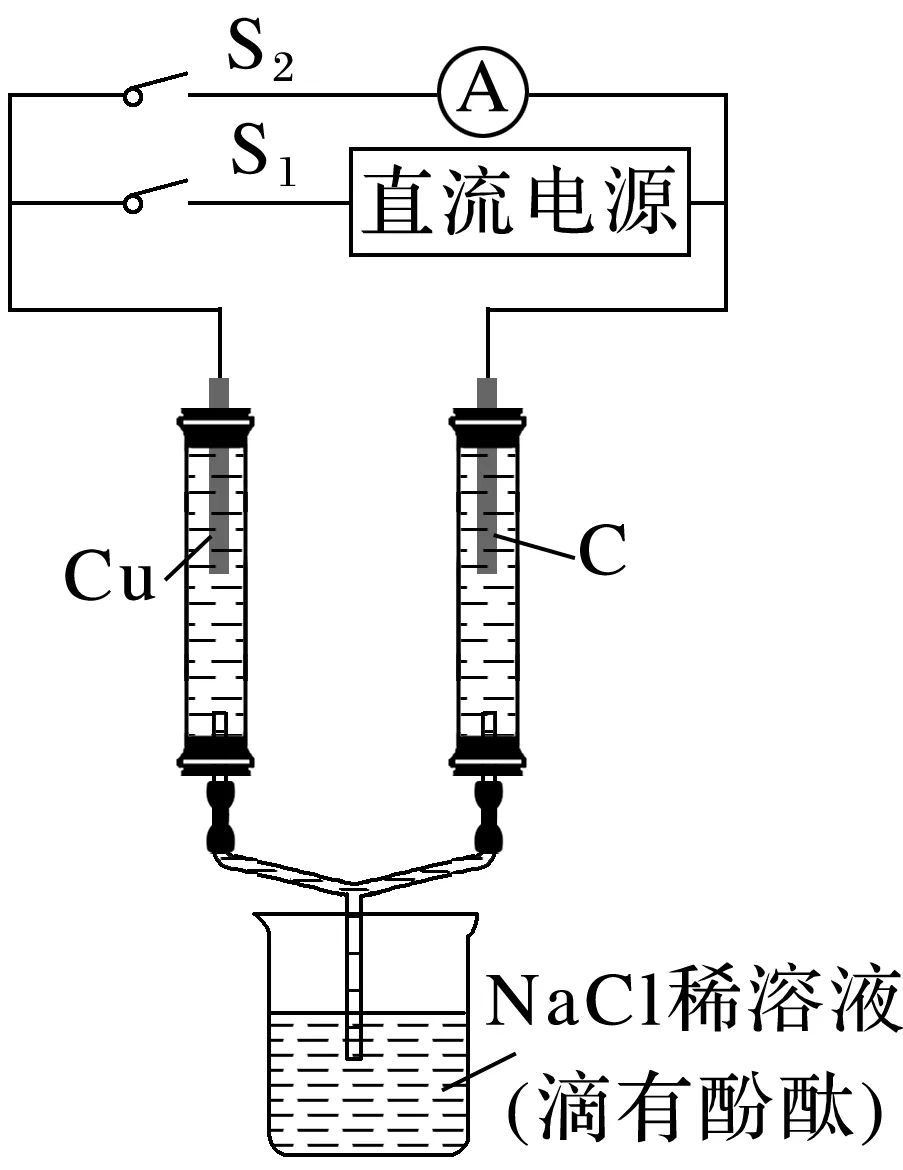
3.如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答下列问题:
(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=______________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=________(Kw=1.0×10-14)。
三、多室装置——离子交换膜的作用
1.常见的离子交换膜
离子交换膜是一种含离子基团的、对溶液中的离子具有选择透过功能的膜,通常由特殊高分子材料制成。
离子交换膜分为
(1)阳离子交换膜:只允许阳离子通过,不允许阴离子通过。
(2)阴离子交换膜:只允许阴离子通过,不允许阳离子通过。
(3)质子交换膜:只允许H+通过,不允许其他阳离子或阴离子通过。
(4)双极隔膜:是一种新型离子交换膜,其膜主体可分为阴离子交换层、阳离子交换层和中间界面层,水解离催化剂被夹在中间的离子交换聚合物中,水电离的产物H+和OH-可在电场力的作用下快速迁移到两侧溶液中,为膜两侧的半反应提供各自理想的pH条件。
2.离子交换膜的作用
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性地允许离子通过,起到平衡电荷、形成闭合回路的作用。
3.典例剖析
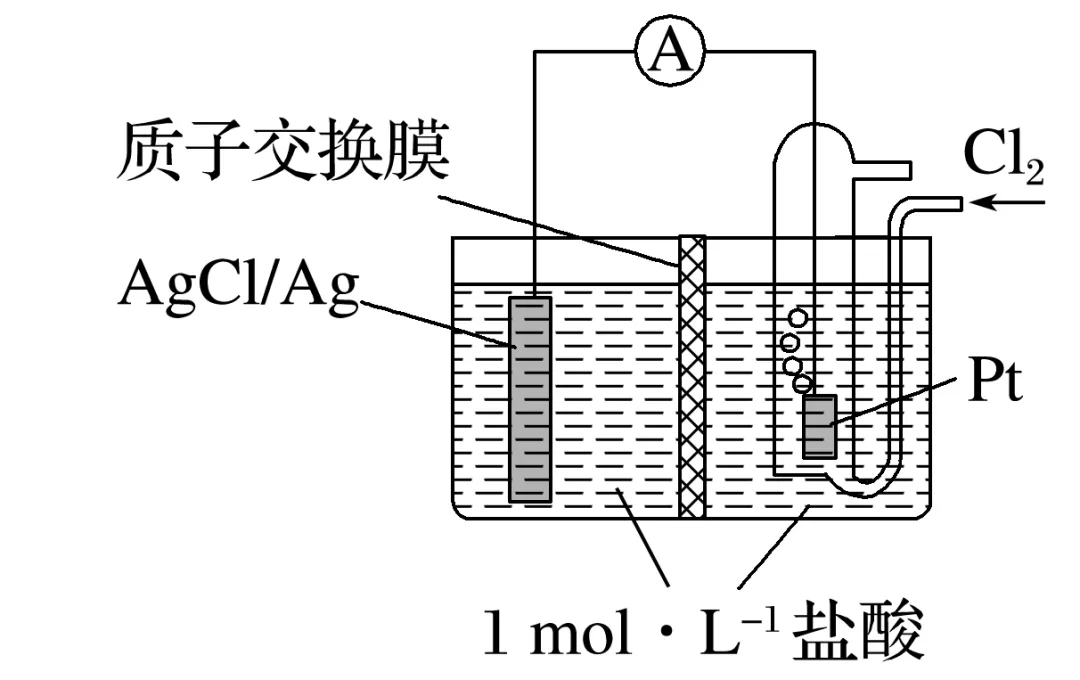
例1 某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl,当电路中转移a mol电子时,交换膜左侧溶液中约减少________ mol离子。交换膜右侧溶液中c(HCl)____(填“>”“<”或“=”)1 mol·L-1(忽略溶液体积变化)。
例2 (2021·广东,16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
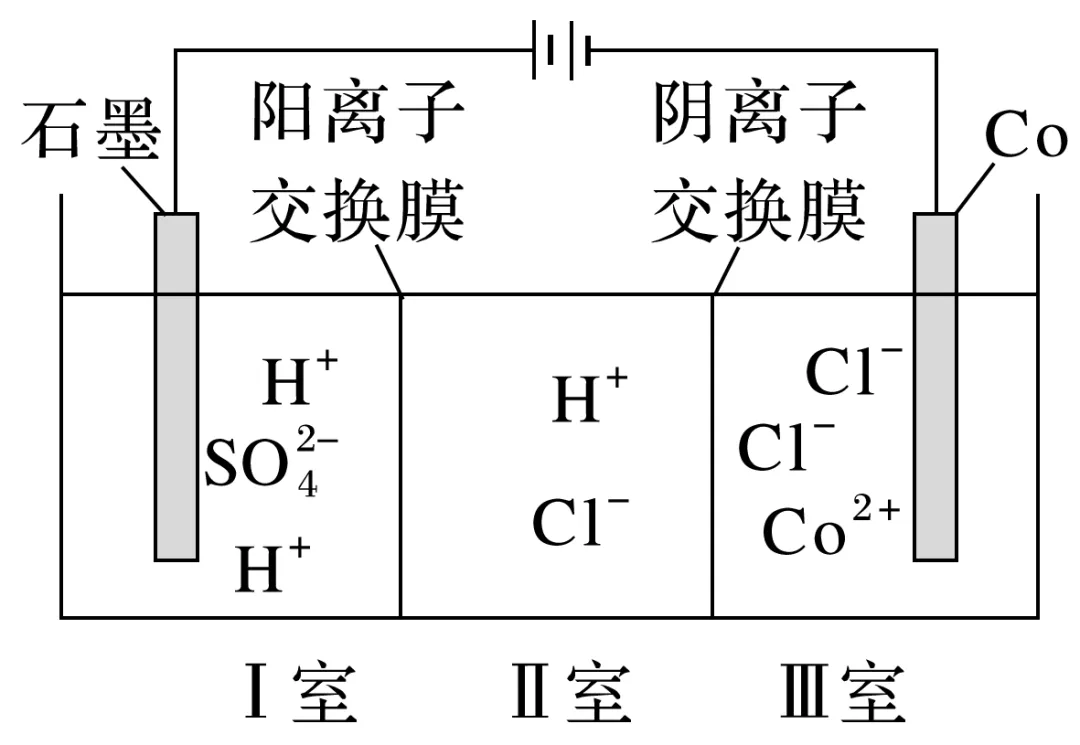
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:2Co2++2H2O电解2Co+O2↑+4H+
例3 H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
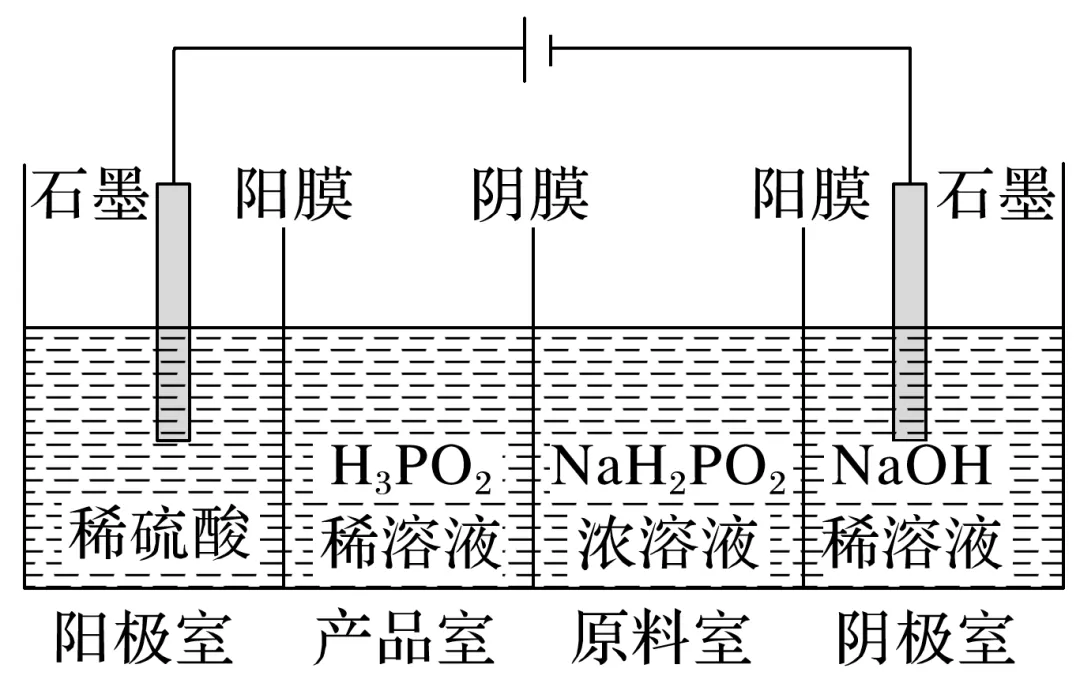
(1)写出阳极的电极反应式:__________________________________________________。
(2)分析产品室可得到H3PO2的原因:__________________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是_____________________________________。

1.(2023·山东师大附中期中)科研人员发明了一种AlPbO2电池,通过X和Y两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,电解质分别为KOH、K2SO4、H2SO4,结构示意图如图(已知a>b)。该电池放电时,下列说法错误的是( )
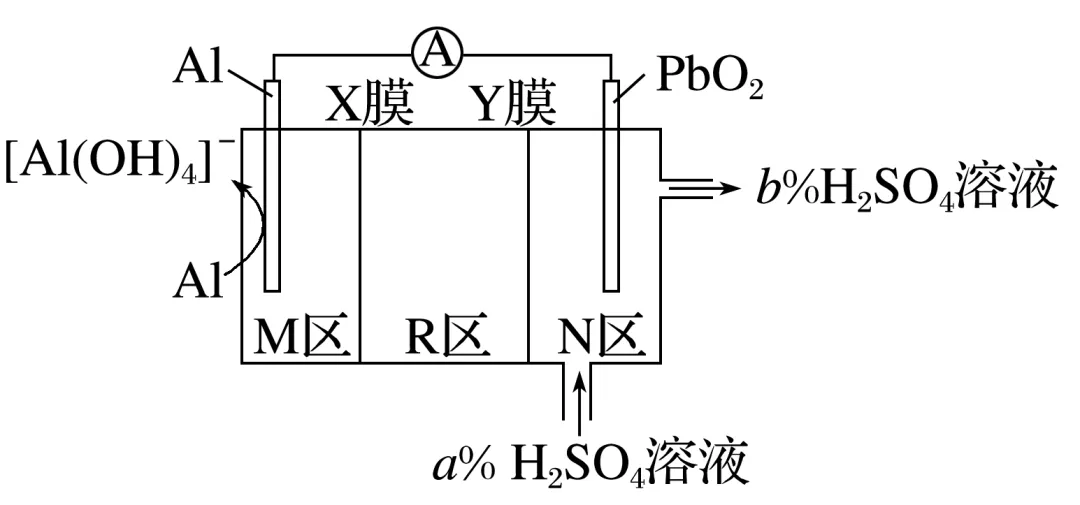
A.R区K2SO4浓度逐渐增大
B.K+通过X膜由M区移向R区
C.N区电极反应为PbO2+2e-+4H++SO2-4===PbSO4+2H2O
D.每消耗1.8 g Al,N区电解质溶液减少19.2 g
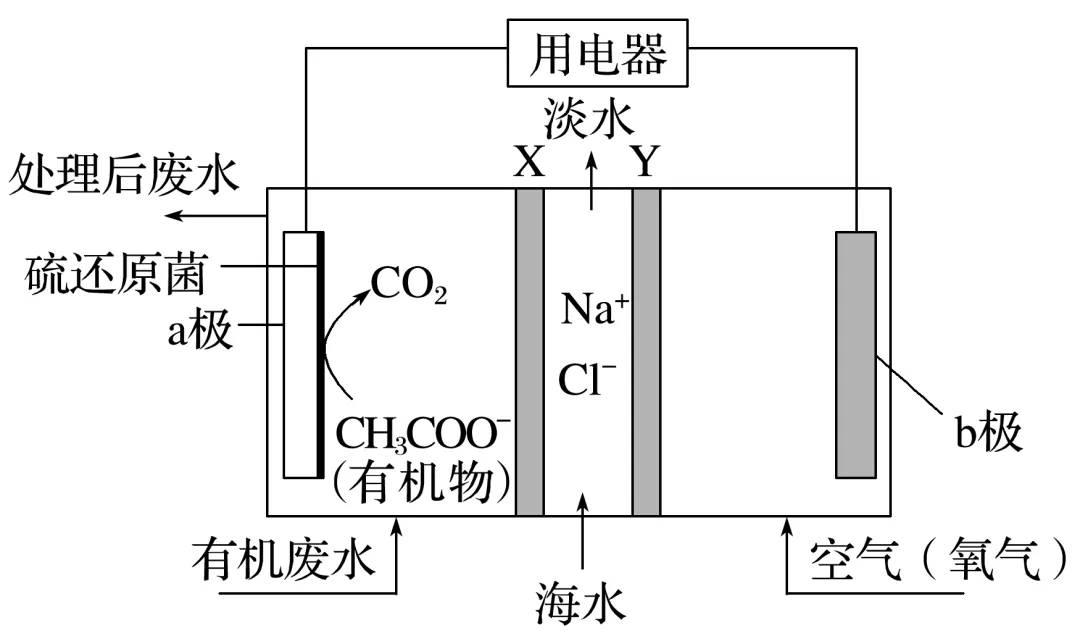
2.(2023·苏州高二月考)如图装置是一种微生物脱盐电池的装置,它可以通过处理有机废水(以含CH3COO-的溶液为例)获得电能,同时还可实现海水淡化。已知a、b电极为惰性电极,X、Y均为离子交换膜,下列说法错误的是( )

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享