 n
n
第2课时 氨和铵盐
[核心素养发展目标] 1.掌握NH3的性质。2.掌握铵盐的性质及N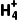 的检验方法。3.掌握喷泉实验的原理及拓展应用。
的检验方法。3.掌握喷泉实验的原理及拓展应用。
一、氨的性质
1.物理性质
状态 | 气味 | 密度 | 水溶性 | 沸点 |
无色气体 | 有刺激性气味 | 比空气小 | 极易溶于水(常温常压1∶700) | 较低,易液化,作制冷剂 |
2.化学性质
(1)实验探究
实验装置 | 操作及现象 | 结论 |
| ①打开弹簧夹,并挤压胶头滴管; ②烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色 | 氨极易溶于水,其水溶液(俗称氨水)呈碱性 |
| 将分别蘸有浓盐酸和浓氨水的玻璃棒靠近,产生白烟 | 氨与氯化氢均易挥发,反应生成白色晶体 |
(2)氨的化学性质
(3)氨水
氨水呈弱碱性,且不稳定,加热时易分解成NH3,NH3·H2ONH3↑+H2O。
思考喷泉是一种常见的现象,其产生的原因是存在压强差。
(1)图1装置中的气体a可能为①氯气、②氢气、③氨气、④氯化氢、⑤二氧化碳。
打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是哪些?
提示③④
(2)若液体b为氢氧化钠浓溶液时,①②④⑤能产生喷泉现象的气体a可能是哪些?
提示①④⑤
(3)如果只提供如图2的装置(气体为氨气,液体为水),请说明引发喷泉的方法。
提示打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾。
(4)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体进行喷泉实验。请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=。
②若用NO2气体,则c(HNO3)=。
提示①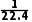 mol·L-1②
mol·L-1②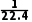 mol·L-1
mol·L-1
解析设圆底烧瓶的容积为VL,则圆底烧瓶内气体的物质的量都为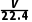 mol。①HCl气体形成喷泉后,溶液充满烧瓶,则溶液体积为VL,c(HCl)=
mol。①HCl气体形成喷泉后,溶液充满烧瓶,则溶液体积为VL,c(HCl)=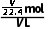 =
=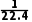 mol·L-1。②NO2气体形成喷泉后,溶质为HNO3,据化学方程式:
mol·L-1。②NO2气体形成喷泉后,溶质为HNO3,据化学方程式:
3NO2+H2O===2HNO3+NO,
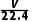 mol
mol 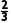 ×
×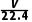 mol
mol
形成喷泉后溶液体积为VL,
则c(HNO3)=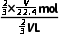 =
=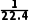 mol·L-1。
mol·L-1。
1.判断正误
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)1 mol·L-1的氨水中c(NH3·H2O)为1 mol·L-1( )
(3)氨水可以导电,所以NH3为电解质( )
(4)浓氨水与所有酸反应均有白烟产生( )
(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
答案 (1)√ (2)× (3)× (4)× (5)√
2.(2023·山东济宁高一期末)氨是一种重要的化工原料。下列关于氨的性质的描述不正确的是( )
A.有刺激性气味,密度比空气的小
B.与氯化氢反应产生白烟
C.能使湿润的蓝色石蕊试纸变红
D.其水溶液能使酚酞溶液变红
答案 C
解析 NH3与HCl反应生成NH4Cl晶体,产生白烟,B正确;能使湿润的蓝色石蕊试纸变红的气体是酸性气体,NH3是碱性气体,C错误;NH3与H2O反应生成NH3·H2O,溶液呈碱性,能使酚酞溶液变红,D正确。
3.(2024·兰州高一期中)探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物,装置如图。
(1)无水硫酸铜的作用是,有同学认为需要在无水硫酸铜的后面再接一个装有无水CaCl2固体的球形干燥管,这样做的目的是。
(2)实验中观察到a中CuO粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为。
(3)若向a中通入标准状况下4.48 L的氨气,最终得到铜的质量为g。
答案 (1) 检验是否有水生成 排除空气中水蒸气对水检验的干扰 (2)3CuO+2NH3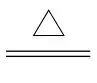 2↑+3Cu+3H2O (3)19.2
2↑+3Cu+3H2O (3)19.2
解析(3)标准状况下4.48L的氨气的物质的量为0.2mol,根据化学方程式进行计算,最终得到铜的物质的量为0.3mol,铜的质量为64g·mol-1×0.3mol=19.2g。

NH3还原性的表现
4NH3+5O2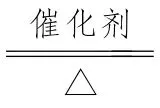 2O(工业制HNO3的重要反应之一)。4NH3+6NO5N2+6H2O或8NH3+6NO2
2O(工业制HNO3的重要反应之一)。4NH3+6NO5N2+6H2O或8NH3+6NO2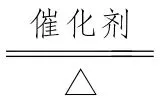 2+12H2O(除NO或NO2毒气)。2NH3+3CuON2+3Cu+3H2O。8NH3+3Cl2===N2+6NH4Cl(检查Cl2管道是否发生泄漏)。
2+12H2O(除NO或NO2毒气)。2NH3+3CuON2+3Cu+3H2O。8NH3+3Cl2===N2+6NH4Cl(检查Cl2管道是否发生泄漏)。
二、铵盐的性质、N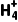 的检验
的检验
1.铵盐
铵盐在农业上常用作化肥,如硫酸铵、碳酸氢铵、硝酸铵等,绝大多数铵盐易溶于水,受热易分解,与碱反应会放出氨。
2.N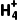 的检验
的检验
(1)实验探究
实验操作 |
三支试管中分别盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液 |
实验现象 | 三支试管中均有无色气体放出,均使湿润的红色石蕊试纸变蓝色 |
实验原理 | 离子方程式:N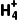 +OH- +OH- NH3↑+H2O NH3↑+H2O |
应用 | 检验N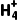 的存在和制取氨 的存在和制取氨 |
(2)铵盐(N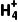 )的检验流程
)的检验流程

特别提醒取少许样品于试管中,加入强碱后加热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有N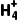 。
。
1.判断正误
(1)绝大多数铵盐易溶于水,可作氮肥,贮存时要密封包装且放于阴凉处( )
(2)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无N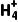 ( )
( )
(3)NH4Cl受热易分解,所以可用加热的方法分离NH4Cl和NaCl( )
(4)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为N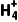 +OH-
+OH- 3↑+H2O( )
3↑+H2O( )
答案 (1)√ (2)× (3)√ (4)×
2.(2024·乌鲁木齐高一段考)下列对于铵盐的描述都正确的是( )
①绝大多数都溶于水 ②都是白色或无色晶体 ③都有刺激性气味 ④加热后都有氮气放出 ⑤与碱混合后加热都有氨气放出
A.全部B.①②④
C.①②⑤D.③④⑤
答案 C
解析铵盐都是白色晶体,都易溶于水,能与强碱混合加热反应生成氨气, 故选C。
1.(2024·江苏连云港高一段考)氨是一种重要的化工原料,可用于制备硝酸等工业。工业合成氨反应:N2(g)+3H2(g)2NH3(g)。下列有关氨的说法不正确的是( )
A.工业合成氨属于人工固氮
B.NH3的水溶液能导电,NH3·H2O是电解质
C.工业合成氨中N2做还原剂
D.氨的喷泉实验说明NH3极易溶于水
答案 C
解析氨的水溶液能导电是因为一水合氨能电离产生自由移动的离子,所以一水合氨是电解质。
2.下列说法正确的是( )
A.铵盐都能与碱反应,不能与酸反应
B.铵盐受热分解一定都会产生NH3
C.NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为N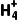 +OH-
+OH-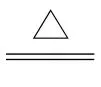 3↑+H2O
3↑+H2O
D.可以用NaOH溶液鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液
答案 C
3.下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨气是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、N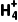 的物质的量之和为1 mol
的物质的量之和为1 mol
答案 D
解析溶于水的氨气大部分与水反应生成NH3·H2O,所以除水外物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、N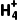 、OH-和少量的H+,是一种混合物,液氨是纯净物。
、OH-和少量的H+,是一种混合物,液氨是纯净物。
4.某化学兴趣小组利用图示装置探究氨的性质。

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享