

第2课时 常见化学电源(一)——一次电池和二次电池
[核心素养发展目标] 1.了解化学电源种类并认识化学电源在实际生活中的应用。2.掌握一次电池、二次电池的反应原理并能书写电极反应式。
一、一次电池及工作原理
1.化学电源概述
(1)化学电源的分类
________是各种化学电源的雏形,化学电源包括________、________和________。
(2)判断电池优劣的主要标准
①比能量:________或________所能输出________的多少。
②比功率:________或________所能输出________的大小。
③电池可储存时间的长短。
2.一次电池
(1)一次电池是________________的电池,其电解质溶液制成胶状,不流动,又叫干电池。
(2)常见的一次电池
一次电池(干电池)普通锌锰电池碱性锌锰电池锌银电池
(3)优点:结构简单、价格低廉;缺点:会发生自放电,不能长期放置。
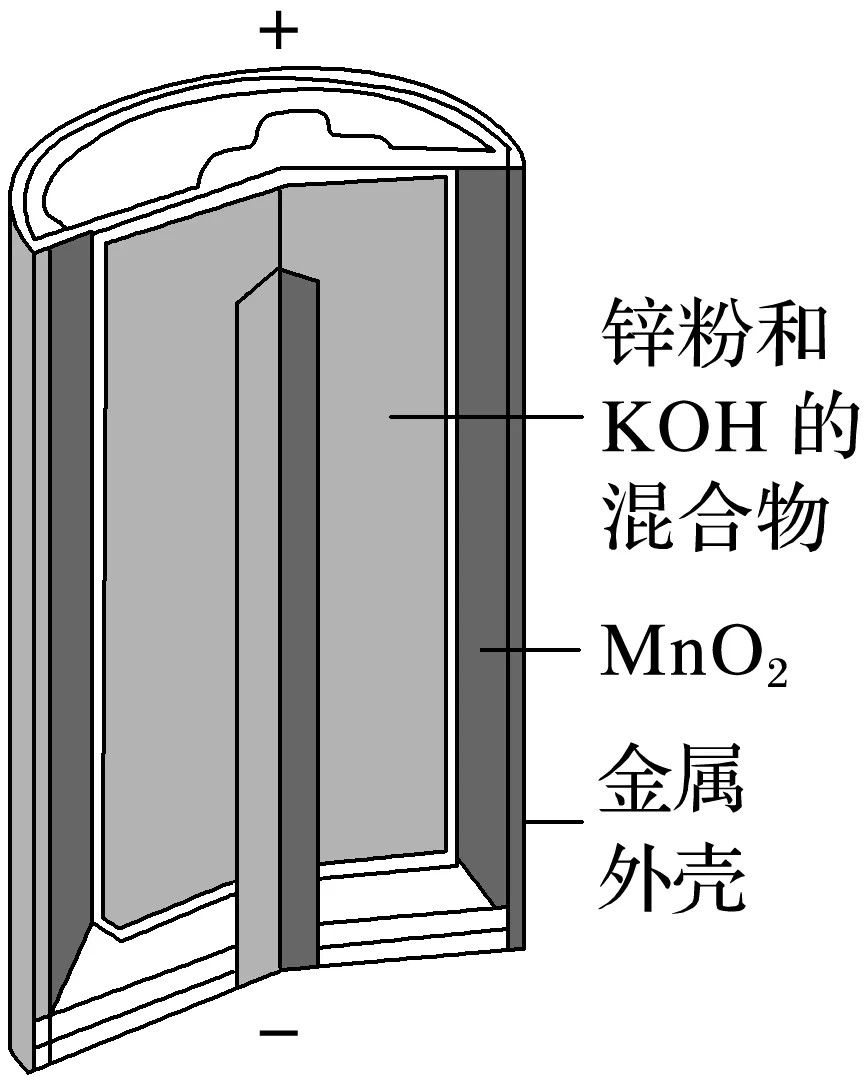
(4)实例分析——碱性锌锰电池
①电池构造
负极反应物:________;正极反应物:________;电解质:________。
②工作原理
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。
负极反应式:________________________________________________________________;
正极反应式:________________________________________________________________。

(1)镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵( )
(2)在干电池中,碳棒只起导电作用,并不参加化学反应( )
(3)干电池根据电池内的电解质分为酸性电池和碱性电池( )
(4)碱性锌锰电池是一次电池,其中MnO2是催化剂,可使碱性锌锰电池的比能量高、可储存时间长( )

1.普通锌锰电池的电池反应一般认为是Zn + 2MnO2 + 2NH4Cl === Zn(NH3)2Cl2+ 2MnO(OH),其构造如图。
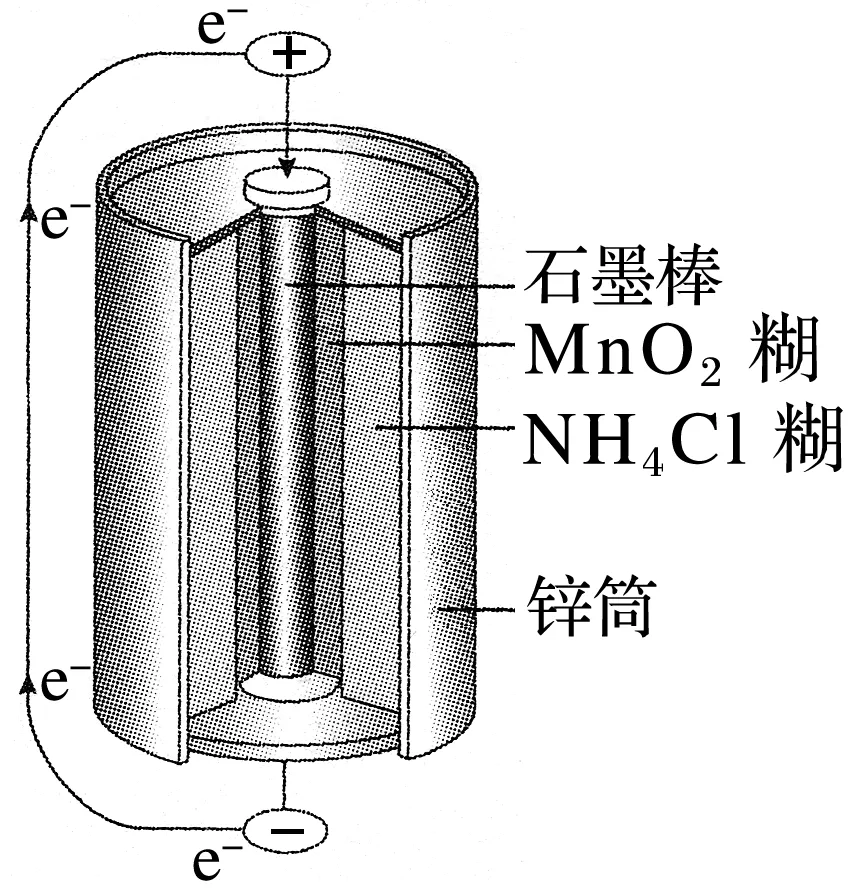
根据电池反应及构造图,解答:
(1)负极材料是________,负极反应式:________________________________________。
(2)正极材料是________,正极反应式:________________________________________。
(3)电解质溶液是________。
2.纽扣式锌银电池
总反应式:Zn+Ag2O===ZnO+2Ag,根据示意图解答:
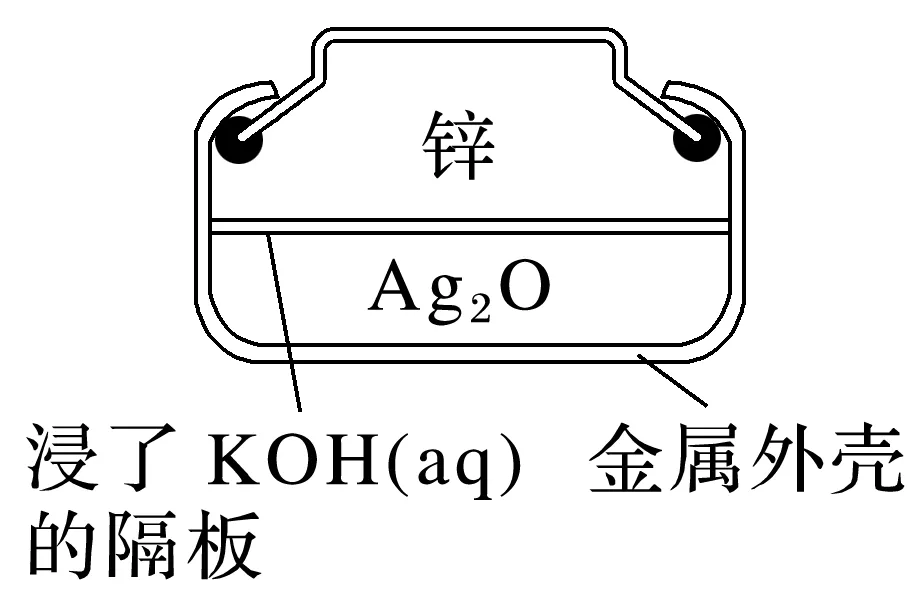
(1)负极反应物为________,反应式:________________________________________。
(2)正极反应物为________,反应式:_________________________________________。
(3)电解质溶液是________。

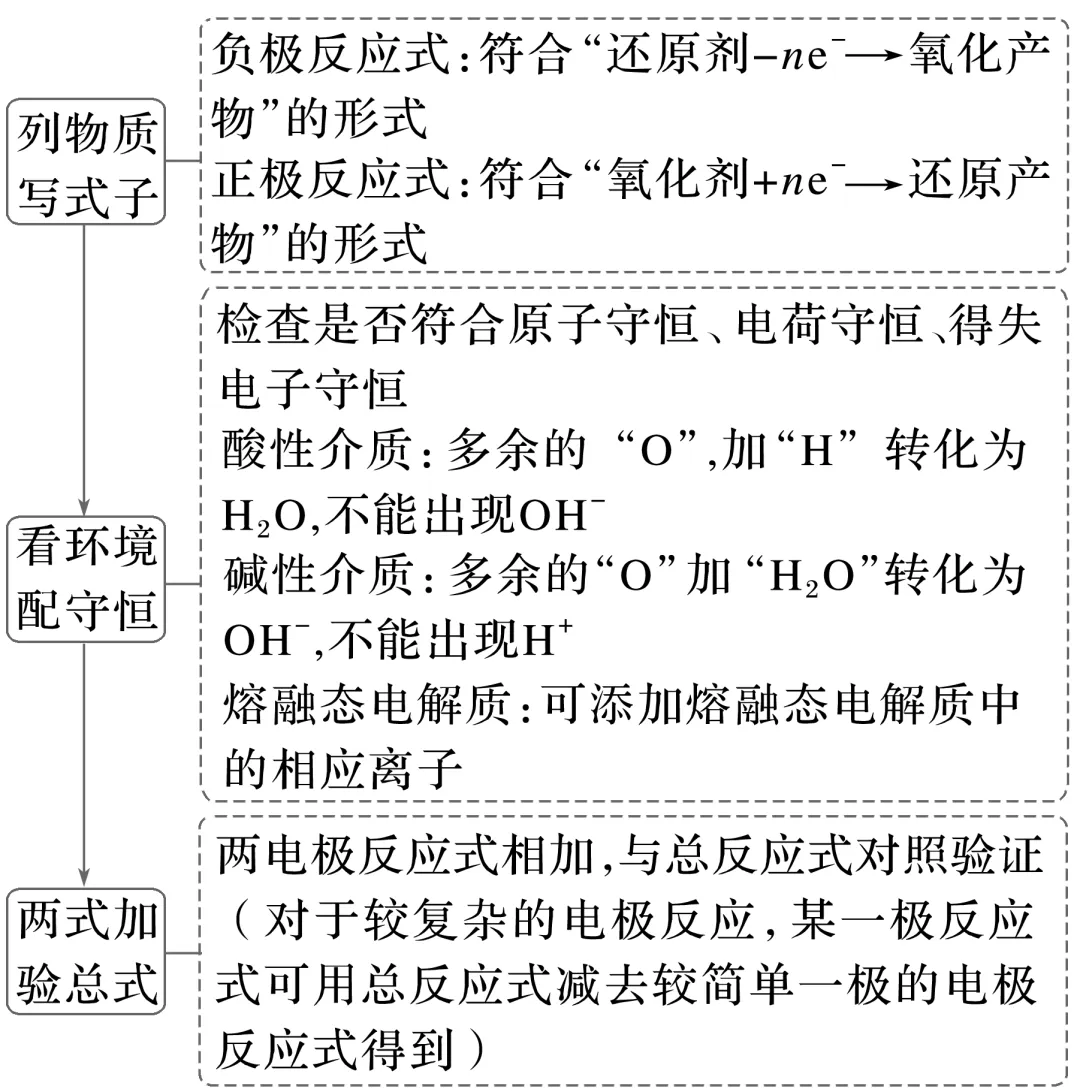
已知原电池总反应式,书写电极反应式的方法
(1)分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。
(2)若某一电极反应较难书写,可先写出较简单的电极反应式,然后利用总反应式减去该电极反应式即可得到另一电极反应式。
二、二次电池
1.二次电池
又称______________或________,是一类放电后可以再充电而________的电池。
2.实例分析——铅酸蓄电池
(1)电池构造
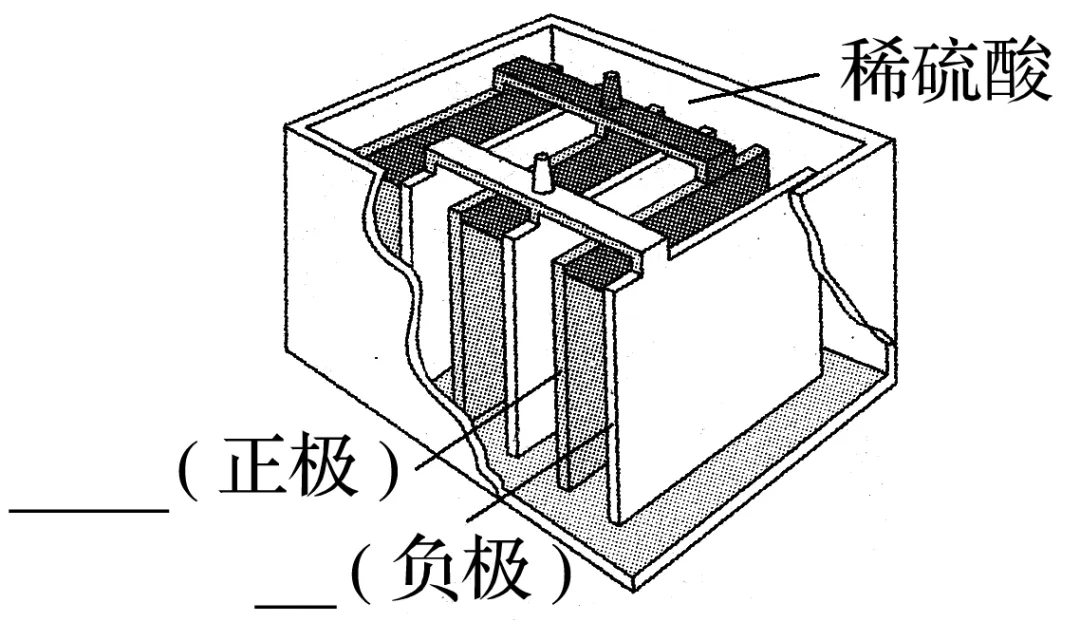
放电反应和充电反应总反应式表示如下:
Pb+PbO2+2H2SO4放电充电2PbSO4+2H2O。
(2)放电反应原理
①负极反应式:_______________________________________________________________;
②正极反应式:_______________________________________________________________;
③放电过程中,负极质量________,稀H2SO4的浓度________。
(3)充电反应原理:充电过程与其放电过程相反。
(4)铅酸蓄电池的优缺点
①优点:电压稳定、使用方便、安全可靠、价格低廉。
②缺点:比能量低、笨重。

(1)手机、电脑中使用的锂离子电池属于一次电池( )
(2)铅酸蓄电池放电时,正极与负极质量均增加( )
(3)铅酸蓄电池中的PbO2为负极( )
(4)铅酸蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g( )

(2023·广东湛江期中)铅酸蓄电池是一种常见的电池,下列说法不正确的是( )
A.铅酸蓄电池是二次电池,充电时电能转化为化学能
B.放电时,外电路中电子由Pb流向PbO2
C.放电时,负极反应为Pb-2e-===Pb2+
D.放电时,H+移向PbO2

(1)二次电池充电时的电极连接方法——正接正,负接负。
(2)充电时的电极反应式的书写
放电时的负极反应式颠倒过来充电时的阴极反应式
放电时的正极反应式颠倒过来充电时的阳极反应式
三、拓展——锂离子电池 复杂电极反应式的书写
1.锂离子电池
锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备(如智能手机、笔记本电脑等)和交通工具(如电动汽车、电动自行车等)的常用电池。
(1)一种可充电锂离子电池——钴酸锂嵌锂石墨电池,其电池反应为LixCy+Li1-xCoO2===LiCoO2+Cy。
①写出电池放电时的电极反应式。
负极:________________________________________________________________________;
正极:________________________________________________________________________。
②简述放电和充电过程中Li+运动情况。
_______________________________________________________________________________
_______________________________________________________________________________
(2)磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,电池总反应为Li1-xFePO4+LixC6放电充电LiFePO4+C6,其原理如图所示。
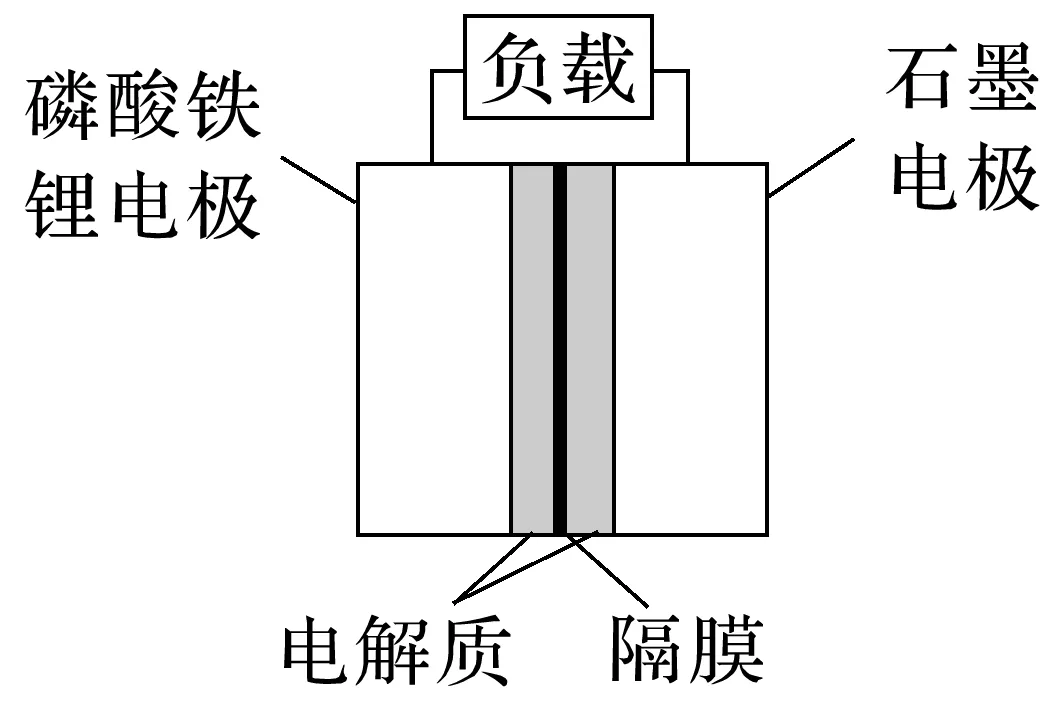
①放电时,负极是______,Li+移向________电极,正极的电极反应式为________________________________________________________________________
________________________________________________________________________。
②充电时,原电池的负极称为阴极,正极称为阳极。阴极反应式为________________________________________________________________________
________________________________________________________________________;
阳极反应式为____________________________________________________________
________________________________________________________________________。
2.复杂电池反应中电极方程式的书写

1.(2024·郑州市第四十七中学高二检测)钠离子电池比锂离子电池更稳定,造价更低。某钠离子电池结构

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享