

第一至三节提升课
第1课时 溶液中粒子浓度关系比较
[核心素养发展目标] 1.掌握电解质溶液中粒子浓度间的三种守恒关系。2.掌握比较粒子浓度关系的一般方法。
一、溶液中的三种守恒关系
1.根据电离平衡理论和水解平衡理论分析离子(分子)种类
现有0.1 mol·L-1下列溶液(常温),完成下表:
| 离子种类 | 分子种类 | 产生原因(用离 子方程式表示) |
NaF | | | |
NaHSO3 | | | |
Na3PO4 | | | |
2.写出下列指定溶液的守恒关系(常温)
(1)氯化铵溶液
①电荷守恒:_____________________________________________________________
________________________________________________________________________;
②元素守恒:____________________________________________________________
________________________________________________________________________;
③质子守恒:____________________________________________________________
________________________________________________________________________。
提醒 ①+②消去与平衡关系无关的c(Cl-),可得③的质子守恒式。
(2)硫化钠(Na2S)溶液
①电荷守恒:___________________________________________________________
________________________________________________________________________;
②元素守恒:____________________________________________________________
________________________________________________________________________;
③质子守恒:____________________________________________________________
________________________________________________________________________。

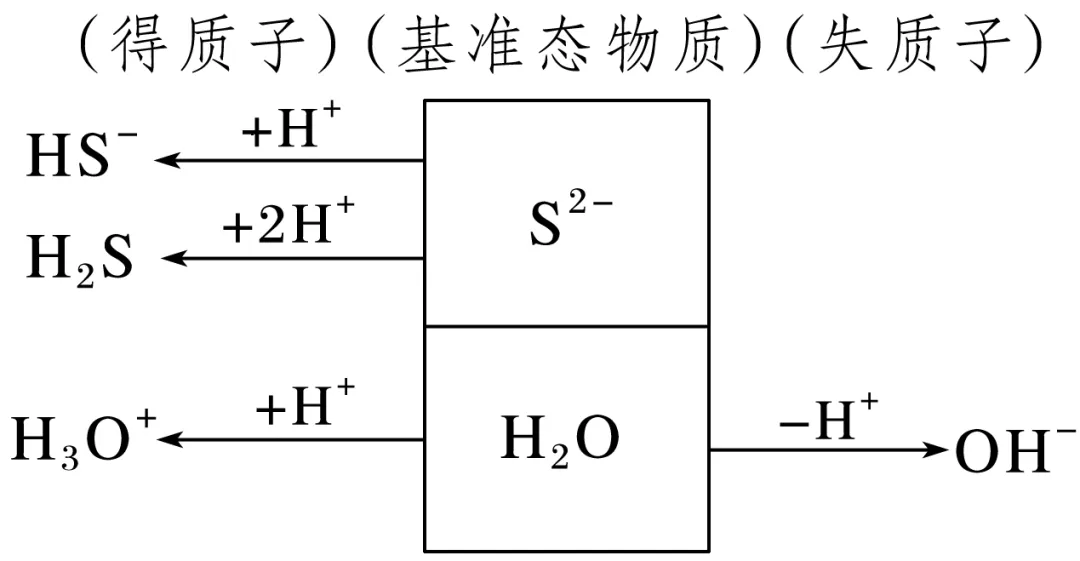
质子守恒式的书写
(1)电荷守恒式与元素守恒式联立,消去未参与水解平衡的微粒,即可得质子守恒式。如,Na2S水溶液中的质子守恒可以将②中c(Na+)代入①中的等式,化简后可得③。
(2)分析Na2S水溶液中的质子转移情况,如下图:
(3)0.1 mol·L-1(NH4)2CO3溶液
①电荷守恒:_____________________________________________________________
________________________________________________________________________;
②元素守恒:____________________________________________________________
________________________________________________________________________。
(4)KHCO3溶液
①电荷守恒:____________________________________________________________
________________________________________________________________________;
②元素守恒:____________________________________________________________
________________________________________________________________________;
③质子守恒:____________________________________________________________
________________________________________________________________________。
(5)将浓度分别为0.1 mol·L-1 CH3COOH和CH3COONa溶液等体积混合
①电荷守恒:____________________________________________________________
________________________________________________________________________;
②元素守恒:_____________________________________________________________
________________________________________________________________________。
二、溶液中粒子浓度大小的比较(常温)
1.单一盐溶液中粒子浓度的比较
(1)0.1 mol·L-1Na2S溶液中各离子浓度的大小关系:_____________________________。
(2)0.1 mol·L-1 NaHCO3溶液中Na+、HCO-3、H2CO3、CO2-3四种粒子浓度的大小关系:________________________________________________________________________。
(3)已知0.1 mol·L-1NaHSO3溶液pH<7,则其溶液中Na+、HSO-3、H2SO3、SO2-3四种粒子浓度的大小关系:_____________________________________________________________。
2.混合溶液中粒子浓度的比较
(1)等物质的量浓度的CH3COONa与CH3COOH的混合溶液呈酸性,溶液中粒子(水分子除外)浓度关系:________________________________________。
(2)已知Ka(HCN)=6.2×10-10,等物质的量浓度的NaCN和HCN的混合溶液中粒子(水分子除外)浓度关系:________________________________________。
3.溶液混合能发生反应的粒子浓度比较
(1)CH3COOH与NaOH溶液混合
①等浓度等体积混合,离子浓度大小顺序为
________________________________________________________________________。
②NaOH溶液和CH3COOH溶液等浓度按1∶2体积比混合后pH<7,离子浓度大小顺序为________________________________________________________________________。
③pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,其离子浓度大小顺序为________________________________________________________________________。
(2)0.1 mol·L-1 的氨水与0.1 mol·L-1的硫酸等体积混合。
①混合液中溶质为_______________________________________,其________ mol·L-1。
②溶液中含有的粒子有______________________________________________________
________________________________________________________________________。
③写出上述溶液中离子浓度由大到小的顺序:__________________________________。
(3)0.1 mol·L-1 CH3COONa与0.1 mol·L-1盐酸等体积混合。
①混合液中溶质为________________。
②溶液中含有的粒子有_____________________________________________________
________________________________________________________________________。
③溶液中粒子(水分子除外)浓度由大到小的顺序:_____________________________
________________________________________________________________________。
(4)0.2 mol·L-1 NH4Cl与0.1 mol·L-1 NaOH等体积混合,混合液中的溶质为________________________________,三者的物质的量浓度________,溶液中离子浓度由大到小的顺序为____________________________________________________________
________________________________________________________________________。

判断混合溶液中粒子浓度大小的一般思路
(1)明确研究对象——溶液的组成(溶质及各种粒子)。
(2)明确溶液中存在的所有平衡(电离平衡、水解平衡)。
(3)根据题给信息,确定程度大小(是以电离为主还是以水解为主)。
(4)比较粒子浓度大小时,要充分运用电荷守恒、元素守恒关系。
4.不同溶液中某一离子浓度的比较
在相同浓度的下列溶液中①NH4Cl,②CH3COONH4,③NH4HSO4,④(NH4)2SO4,⑤(NH4)2CO3,c(NH+4)由大到小的顺序:________________。
三、综合电解质溶液中粒子浓度关系
1.题型概述
溶液中粒子浓度的大小比较是离子平衡的主流试题,既与盐的水解平衡有关,又与弱电解质电离平衡有关。不仅偏重考查粒子的浓度大小顺序,且还侧重溶液中各种守恒(电荷守恒、元素守恒、质子守恒)关系考查,从而使题目具有一定的综合性、灵活性和技巧性,考查学生对变化观念、微观探析的理解和应用。
2.解题模型


1.常温下,将甲酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定c(HCOO-)与c(Na+)的大小关系
2.(2021·天津,10)常温下,下列有关电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 H3PO4溶液中c(H3PO4)>c(H2PO-4)>c(HPO2-4)>c(PO3-4)
B.在0.1 mol·L-1 Na2C2O4溶液中c(Na+)+c(H+)=c(OH-)+c(HC2O-4)+c(C2O2-4)
C.在0.1 mol·L-1 NaHCO3溶液中c(H2CO3)+c(HCO-3)=0.1 mol·L-1
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中c(Cl-)>c(NH+4)>c(OH-)>c(H+)
3.醋酸(CH3COOH)是一种常见的弱酸。常温条件下,下列叙述正确的是( )
A.pH=3的CH3COOH溶液中,c(H+)=c(CH3COO-)
B.pH=8的CH3COOH和CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
C.0.1 mol·L-1CH3COONa溶液中,c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.0.1 mol·L-1CH3COONa溶液中,c(Na+)=c(CH3COO-)+c(OH-)
4.浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是________________________________,c(H2S)从大到小的顺序是______________________________。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享