n
整理与提升
一、体系构建
1.共价键和分子的空间结构
2.分子结构与物质的性质
(1)共价键的极性
(2)分子极性
(3)分子间的作用力 →对物质性质的影响
→对物质性质的影响
(4)溶解性
(5)分子的手性
二、真题导向
考向一共价键与分子的空间结构
1.(2023·湖北,9)价层电子对互斥模型可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH4和H2O的VSEPR模型均为四面体
B.S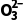 和
和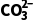 的空间构型均为平面三角形
的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
2.[2022·全国乙卷,35(2)①②]卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(2)①一氯乙烯(C2H3Cl)分子中,C的一个杂化轨道与Cl的3px轨道形成C—Cl键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键(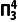 )。
)。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是_______,
理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl越强;(ⅱ) _______。
3.[2022·全国甲卷,35(3)(4)]2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2 CH2)与四氟乙烯(CF2
CH2)与四氟乙烯(CF2 CF2)的共聚物(ETFE)制成。回答下列问题:
CF2)的共聚物(ETFE)制成。回答下列问题:
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构 。
(4) CF2 CF2和ETFE分子中C的杂化轨道类型分别为和;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因:____________________________。
CF2和ETFE分子中C的杂化轨道类型分别为和;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因:____________________________。
4.(1)[2023·山东,16(2)]ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(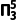 )。ClO2中Cl原子的轨道杂化方式为;键角:O—Cl—O(填“>”“<”或“=”)Cl—O—Cl。比较ClO2与Cl2O中Cl—O的键长并说明原因____________________________。
)。ClO2中Cl原子的轨道杂化方式为;键角:O—Cl—O(填“>”“<”或“=”)Cl—O—Cl。比较ClO2与Cl2O中Cl—O的键长并说明原因____________________________。
(2)[2022·北京,15(2)]比较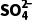 和H2O分子中的键角大小并给出相应解释:______________。
和H2O分子中的键角大小并给出相应解释:______________。
考向二分子结构与物质的性质
5.(2023·重庆,10)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.NCl3和SiCl4的水解反应机理相同
D.NHCl2和NH3均能与H2O形成氢键
6.[2021·全国乙卷,35(3)][Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是,NH3的沸点比PH3的,原因是______________。
H2O 的键角小于NH3的,分析原因______________。
7.[2022·广东,20(2)(3)(4)(5)]硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图。
(2)H2Se的沸点低于H2O,其原因是_____________________。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤电子对的原子有_____________________。
(5)硒的两种含氧酸的酸性强弱为H2SeO4(填“>”或“<”)H2SeO3。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。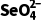 的空间结构为。
的空间结构为。
8.[2022·山东,16(3)(4)(5)](3)吡啶(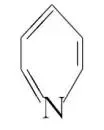 替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的
替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 大π键,则吡啶中N原子的价层孤电子对占据(填标号)。
大π键,则吡啶中N原子的价层孤电子对占据(填标号)。
A.2s轨道B.2p轨道
C.sp杂化轨道D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①_____________________,②______________。
(5)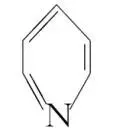 、
、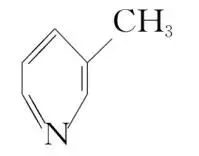 、
、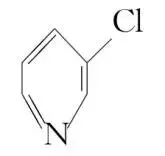 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
答案精析
二、
1.A [甲烷分子的中心原子的价层电子对数为4,水分子的中心原子价层电子对数也为4,所以VSEPR模型均为四面体,A正确;S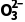 中中心原子的孤电子对数为1,C
中中心原子的孤电子对数为1,C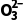 中中心原子的孤电子对数为0,所以S
中中心原子的孤电子对数为0,所以S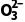 的空间构型为三角锥形,C
的空间构型为三角锥形,C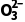 的空间构型为平面三角形,B错误;CF4为正四面体结构,为非极性分子,SF4中心原子有孤电子对,为极性分子,C错误;XeF2和XeO2分子中,中心原子孤电子对数不相等,所以键角不等,D错误。]
的空间构型为平面三角形,B错误;CF4为正四面体结构,为非极性分子,SF4中心原子有孤电子对,为极性分子,C错误;XeF2和XeO2分子中,中心原子孤电子对数不相等,所以键角不等,D错误。]
2.(2)①sp2 σ ②一氯乙烷>一氯乙烯>一氯乙炔 Cl参与形成的大π键越多,形成的C—Cl越强
解析①一氯乙烯的结构式为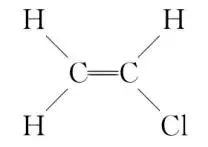 ,碳原子采取sp2杂化,因此C的一个sp2杂化轨道与Cl的3px轨道形成C—Clσ键。②C的杂化轨道中s成分越多,形成的C—Cl越强,C—Cl的键长越短,一氯乙烷中碳采取sp3杂化,一氯乙烯中碳采取sp2杂化,一氯乙炔中碳采取sp杂化,sp杂化时s成分多,sp3杂化时s成分少;同时Cl参与形成的大π键越多,形成的C—Cl的键长越短,一氯乙烯中Cl的3p轨道与C的2p轨道形成3中心4电子的大π键(
,碳原子采取sp2杂化,因此C的一个sp2杂化轨道与Cl的3px轨道形成C—Clσ键。②C的杂化轨道中s成分越多,形成的C—Cl越强,C—Cl的键长越短,一氯乙烷中碳采取sp3杂化,一氯乙烯中碳采取sp2杂化,一氯乙炔中碳采取sp杂化,sp杂化时s成分多,sp3杂化时s成分少;同时Cl参与形成的大π键越多,形成的C—Cl的键长越短,一氯乙烯中Cl的3p轨道与C的2p轨道形成3中心4电子的大π键(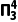 ),一氯乙炔中Cl的3p轨道与C的2p轨道形成2个3中心4电子的大π键(
),一氯乙炔中Cl的3p轨道与C的2p轨道形成2个3中心4电子的大π键(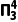 ),因此三种物质中C—Cl键长的顺序为一氯乙烷>一氯乙烯>一氯乙炔。
),因此三种物质中C—Cl键长的顺序为一氯乙烷>一氯乙烯>一氯乙炔。
3.(3) (4)sp2 sp3 C—F的键能大于C—H的键能,键能越大,化学性质越稳定
解析(3)固体HF中存在氢键,则(HF)3的链状结构为。
(4)由于F元素的电负性较大,因此在与C原子结合的过程中形成的C—F的键能大于C—H的键能,键能的强弱决定物质的化学性质,键能越大,化学性质越稳定,因此聚四氟乙烯的化学稳定性高于聚乙烯。
4.(1)sp2 > ClO2分子中Cl—O的键长小于Cl2O中Cl—O的键长,其原因是ClO2分子中既存在σ键,又存在大π键,原子轨道重叠的程度较大,因此其中Cl—O的键长较小,而Cl2O只存在普通的σ键
(2)S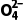 的键角大于H2O分子的键角,S
的键角大于H2O分子的键角,S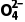 中S原子的价层电子对数为4、孤电子对数为0,离子的空间结构为正四面体形,H2O分子中O原子的价层电子对数为4、孤电子对数为2,分子的空间结构为V形
中S原子的价层电子对数为4、孤电子对数为0,离子的空间结构为正四面体形,H2O分子中O原子的价层电子对数为4、孤电子对数为2,分子的空间结构为V形
解析(1)ClO2中心原子为Cl,Cl2O中心原子为O

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1aX91ROOZJC0j7zSsZs4sQQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享