

第2课时 反应热的计算
[核心素养发展目标] 1.巩固应用盖斯定律进行有关反应热的简单计算。2.能够提取热化学信息,利用多种方法计算化学反应的反应热,建立解决较复杂反应热问题的思维模型。
一、一定量的反应物产生热量的计算
1.计算依据
反应热的绝对值与各物质的物质的量成正比。
2.关系式
(1)依据热化学方程式计算
aA(g)+bB(g)===cC(g)+dD(g) ΔH
a bcd |ΔH|
n(A) n(B) n(C) n(D) Q
则nAa=nBb=nCc=nDd=___________。
(2)依据燃料的燃烧热计算:Q=n(可燃物)×|ΔH|(燃烧热)。

1.已知:FeS2(s)+114O2(g)===12Fe2O3(s)+2SO2(g) ΔH=-853 kJ·mol-1。
计算1 kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量(写出计算步骤)。
________________________________________________________________________
________________________________________________________________________
2.在101 kPa下,H2(g)、CO(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,计算1 mol H2(g)和2 mol CO(g)组成的混合气体完全燃烧释放的热量。
________________________________________________________________________
________________________________________________________________________
3.已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,实验室测得4 mol SO2发生上述化学反应时放出314.3 kJ热量,请计算该反应中SO2的转化率。
________________________________________________________________________
________________________________________________________________________
二、几种常见反应热的计算类型
类型一 已知键能或燃烧热计算型
1.已知反应:CH4(g)+CO2(g)2CO(g)+2H2(g)中相关化学键的键能数据如下:
化学键 | C—H | C==O | H—H | C≡O(CO) |
键能/ (kJ·mol-1) | 413 | 745 | 436 | 1 075 |
该反应的ΔH=________kJ·mol-1。
2.[2020·全国卷Ⅱ,28(1)①]乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol-1) | -1 560 | -1 411 | -286 |
ΔH1=________ kJ·mol-1。
类型二 多步方程式叠加型
3.已知热化学方程式:
①C2H2(g)+52O2(g)===2CO2(g)+H2O(l)
ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)===CO2(g)
ΔH2=-393.5 kJ·mol-1
③H2(g)+12O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)===C2H2(g)的ΔH为( )
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1 301.0 kJ·mol-1
D.+621.7 kJ·mol-1
4.冬季取暖许多家庭用上了清洁能源天然气,实际生产中天然气需要脱硫,在1 200 ℃时,工艺中会发生下列反应:
①H2S(g)+32O2(g)===SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)===32S2(g)+2H2O(g) ΔH2
③H2S(g)+12O2(g)===S(g)+H2O(g) ΔH3
④2S(g)===S2(g) ΔH4。
则ΔH4的正确表达式为______________。
类型三 反应进程图型
5.在微生物作用的条件下,NH+4经过两步反应被氧化成NO-3。两步反应的能量变化示意图如图。
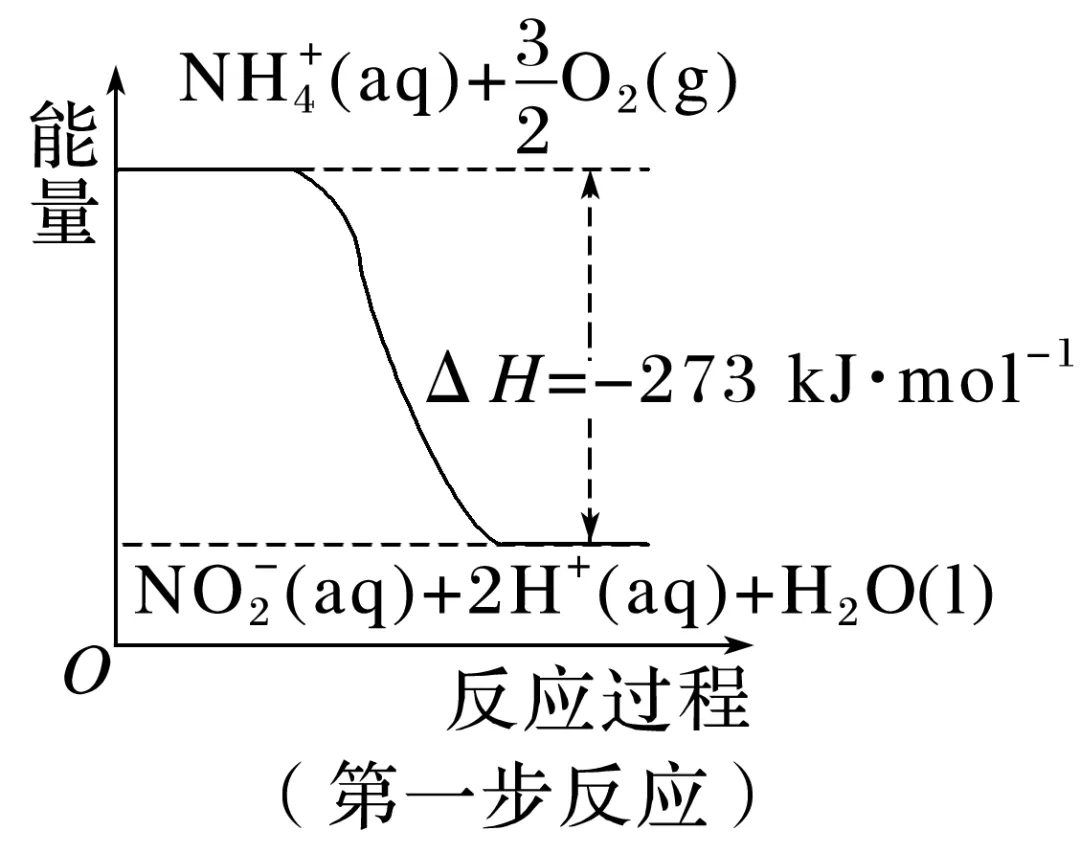
(1)第一步反应是________(填“放热”或“吸热”)反应,判断依据是___________________。
(2)1 mol NH+4(aq)全部被氧化成NO-3(aq)的热化学方程式是____________________________
_______________________________________________________________________________。
6.直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g)HCHO(g)+H2O(g) ΔH,转化步骤如图所示:
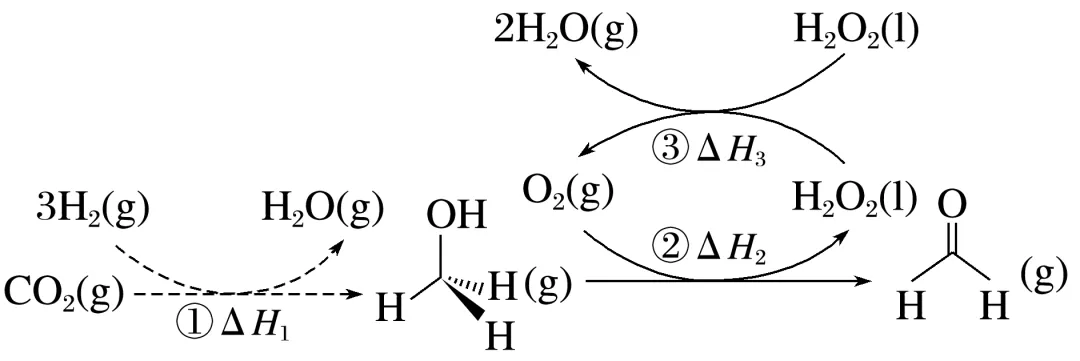
已知2H2(g)+O2(g)===2H2O(g) ΔH4,则总反应的ΔH=_______________________(用图中焓变以及ΔH4表示)。
三、ΔH的大小比较
1.看物质状态。物质的气、液、固三态转化时的能量变化如下:
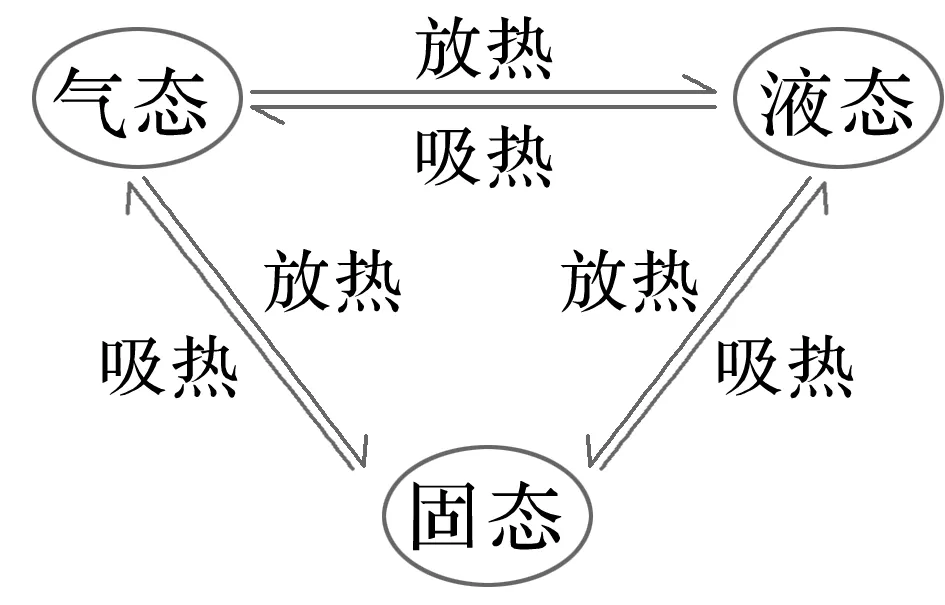
2.看ΔH的符号。比较反应热大小时不要只比较ΔH数值的大小,还要考虑其符号。
3.看化学计量数。当反应物与生成物的状态相同时,化学计量数越大,放热反应的ΔH越小,吸热反应的ΔH越大。
4.看反应的程度。对于可逆反应,参加反应的物质的量和状态相同时,反应的程度越大,热量变化越大。

1.如图为不同聚集状态的硫单质燃烧的反应过程能量变化:
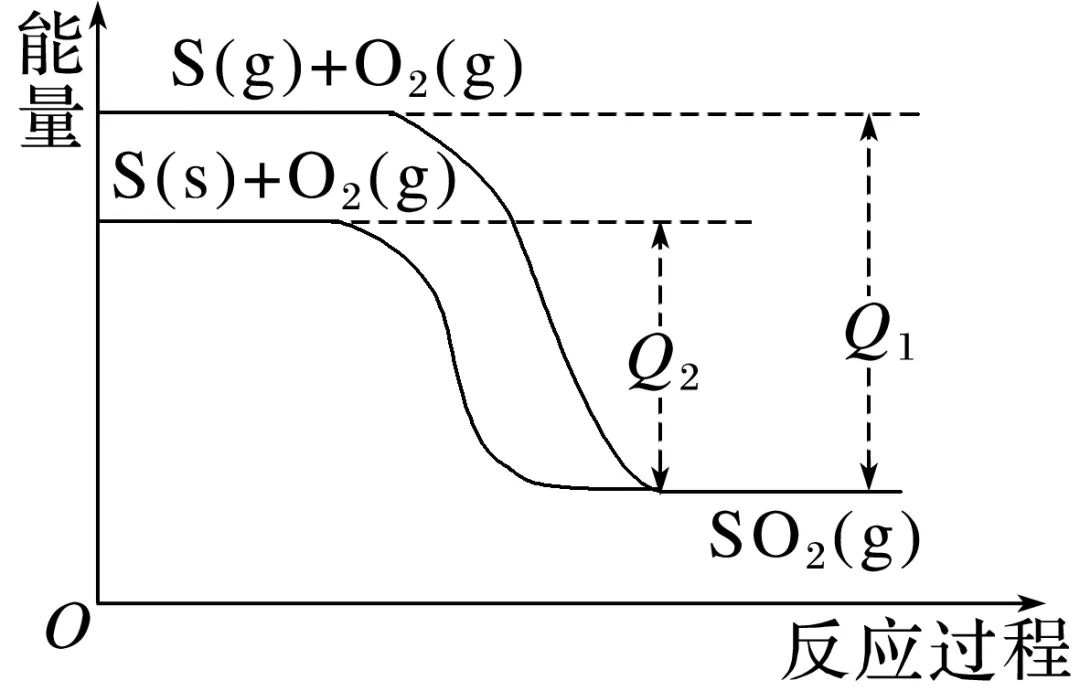
S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2
则:Q1________(填“>”“<”或“=”,下同)Q2,ΔH1________ΔH2。
2.已知:C(s,金刚石)===C(s,石墨)
ΔH=-1.9 kJ·mol-1
C(s,金刚石)+O2(g)===CO2(g) ΔH1
C(s,石墨)+O2(g)===CO2(g) ΔH2
根据上述反应所得出的结论正确的是( )
A.ΔH1=ΔH2B.ΔH1>ΔH2
C.ΔH1<ΔH2D.金刚石比石墨稳定
3.氢氟酸是一种弱酸,可用来刻蚀玻璃。
①HF(aq)+OH-(aq)=== F-(aq)+H2O(l)
ΔH=a kJ·mol-1
②H3O+(aq)+OH-(aq)===2H2O(l) ΔH=b kJ·mol-1
③HF(aq)+H2O(l)H3O+(aq)+F-(aq) ΔH=c kJ·mol-1
④F-(aq)+H2O(l)HF(aq)+OH-(aq)
ΔH=d kJ·mol-1
已知:a<b<0,下列说法正确的是( )
A.HF的电离过程吸热
B.c=a-b,c<0
C.c>0,d<0
D.d=b+c,d<0

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享