

章末提升课
第1课时 平衡常数、速率常数的综合应用
[核心素养发展目标] 1.了解压强平衡常数的概念,掌握速率常数与平衡常数的关系,并能进行多重平衡体系的简单计算。2.通过对复杂平衡体系化学反应速率和化学平衡的分析与计算,建立分析实际工业生产时要从反应的限度、快慢、选择性等综合调控化学反应的意识。
一、压强平衡常数
由于利用压强计算平衡常数更贴近以气体为主的生产实际,是近几年高考计算的常青树。主要包括恒温恒容和恒温恒压两种反应体系,用到的方法主要是利用三段式和定义式的计算。为了便于入题,同学有必要了解分压及分压常数的含义。
1.压强平衡常数(Kp)的概念
在化学平衡体系中,由各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数,用符号Kp表示,其单位与表达式有关。
2.表达式
对于一般的可逆反应mA(g)+nB(g)pC(g)+qD(g),在一定温度下,达到平衡时,其压强平衡常数Kp=ppC·pqDpmA·pnB。其中p(A)、p(B)、p(C)、p(D)表示对应物质的分压。
注意 ①混合气体中某组分的分压=总压×该组分的物质的量分数,pB=p总×nBn总。
②混合气体的总压等于相同温度下各组分气体的分压之和,即p总=pA+pB+pC+…。
例1[2023·湖北,19(4)]纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。
1 200 K时,假定体系内只有反应C40H12(g)C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 解题思路
解题思路 三步计算分压常数
三步计算分压常数
第一步:列三段式,计算平衡时各组分的物质的量,再加和得n(总)。
设起始量为1 mol,则根据信息列出三段式:
C40H12(g)C40H10(g)+H2(g)
起始量/mol 1 0 0
变化量/mol ααα
平衡量/mol 1-ααα
第二步:求分压,先计算n(总)与各组分的物质的量分数,再求平衡时各组分的分压。
用各物质表示的分压分别为p(C40H12)=p0×1-α1+α,p(C40H10)=p0×α1+α,p(H2)=p0×α1+α,
第三步:代入Kp表达式计算分压常数。
Kp=αα1+α1-α1+α=α2·p01-α2。
例2[2023·新课标卷,29(4)③]在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示。其中一种进料组成为xH2=0.75、xN2=0.25,另一种为xH2=0.675、xN2=0.225、xAr=0.10。(物质i的摩尔分数:xi=nin总)
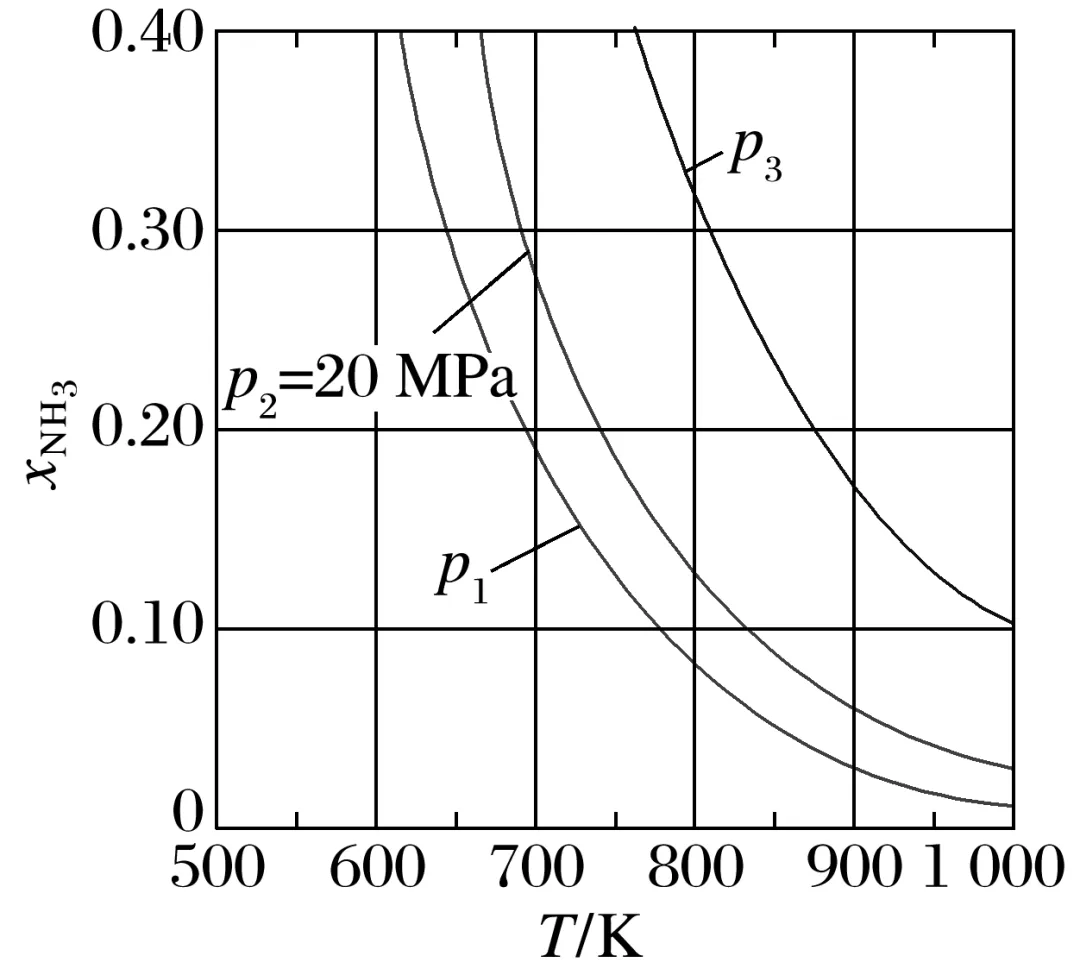
图中,当p2=20 MPa、xNH3=0.20时,氮气的转化率α=________________。该温度时,反应12N2(g)+32H2(g)NH3(g)的平衡常数Kp=________________(MPa)-1(化为最简式)。

1.在300 ℃、8 MPa下,将CO2和H2按物质的量之比为1∶3通入恒压密闭容器中发生反
应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的压强平衡常数Kp=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2.[2021·全国乙卷,28(2)]一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。
氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2, 376.8 ℃时平衡常数Kp=1.0×104 Pa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8 ℃,碘蒸气初始压强为20.0 kPa。376.8 ℃平衡时,测得烧瓶中压强为32.5 kPa,则pICl=_______kPa, 反应2ICl(g)===Cl2(g)+I2(g)的平衡常数K=_______________(列出计算式即可)。

等温等容时,可以用物质的量分数计算分压,也可以用压强直接列三段式计算。
二、速率常数及其与平衡常数的关系
对于反应aA(g)+bB(g)cC(g)+dD(g),若v正、v逆可分别表示为v正=k正·ca(A)·cb(B)、v逆=k逆·cc(C)·dd(D)。达平衡时v正=v逆,平衡常数K=ccC·ddDcaA·cbB=k正·v逆k逆·v正,故K=k正k逆。
例1 2NO(g)+2CO(g)N2(g)+2CO2(g)
ΔH=-746.5 kJ·mol-1,测得在某温度下一定体积的密闭容器中,NO和CO浓度随时间的变化如表所示:
时间/s 浓度/(10-3mol·L-1) | 0 | 2 | 4 | 6 |
c(NO) | 1.00 | 0.25 | 0.10 | 0.10 |
c(CO) | 3.60 | 2.85 | 2.70 | 2.70 |
(1)前4 s内的速率v(NO)=________。
(2)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。在一定温度下,向2 L的密闭容器中充入NO和CO气体各1 mol,NO的转化率为40%时达到化学平衡,则k正k逆=______(保留两位小数)。
例2 Bodenstein研究了反应:2HI(g)H2(g)+I2(g) ΔH>0。 在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(1)根据上述实验结果,该反应的平衡常数K的计算式为__________________。
(2)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)·x(I2),其中k正、k逆为正、逆反应速率常数,则k逆=________(用含K和k正的代数式表示)。若起始时,x(HI)=1,k正=0.002 7 min-1,则在t=40 min时,v正=________min-1(结果保留3位有效数字)。

1.向某恒容密闭容器中充入等物质的量的PCl3(g)和Cl2(g),发生如下反应:PCl3(g)+Cl2(g)PCl5(g),测得不同温度下PCl3(g)的转化率α与时间的关系如图所示。其速率方程为v正=k正·c(PCl3)·c(Cl2),v逆=k逆·c(PCl5)(k是速率常数),下列说法错误的是( )
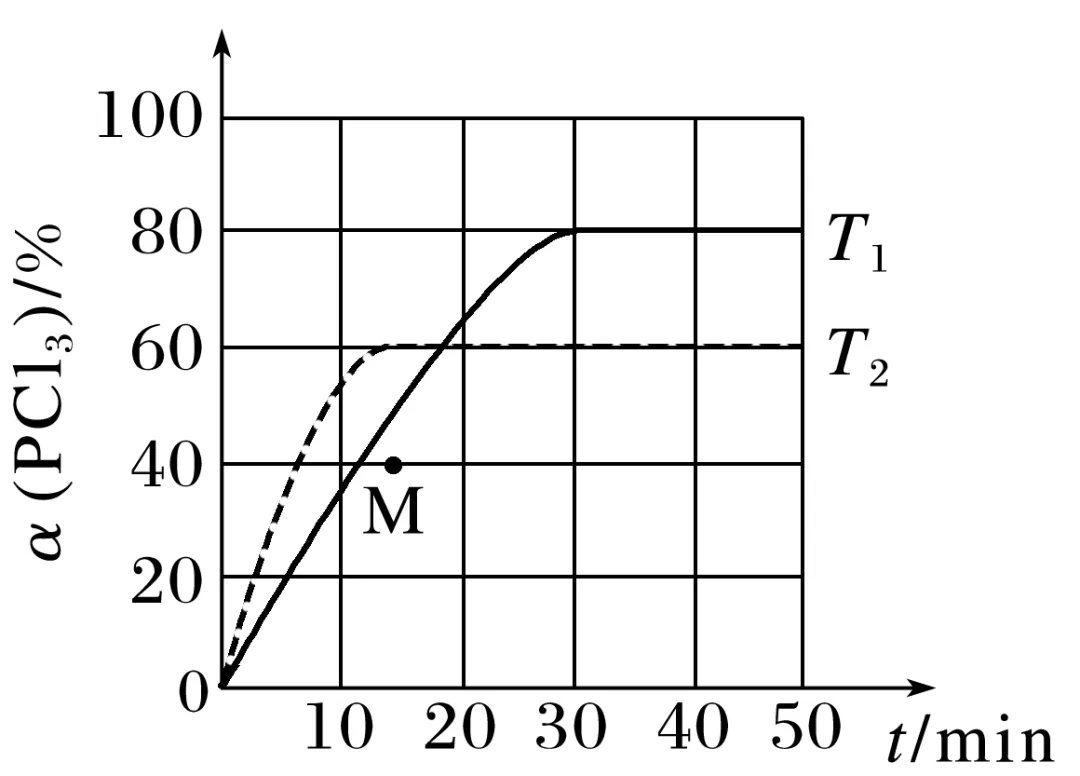
A.该反应的ΔH<0
B.M点:k正k逆>cPCl5cPCl3·cCl2
C.升高温度,k正增大的倍数小于k逆增大的倍数
D.T1时,若平衡体系中c(Cl2)=0.25 mol·L-1,则k正k逆=18
2.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为COS(g)+H2O(g)H2S(g)+CO2(g) ΔH=-35 kJ·mol-1。
(1)向容积为2 L的密闭容器中加入等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应测得一定时间内COS(g)和CO2(g)的物质的量变化如下表所示:
物质的量/mol | T1/℃ | T2/℃ |
0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
COS(g) | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
CO2(g) | 0 | 0.84 | 1.20 | 1.20 | 1.50 | 1.60 | 1.60 |
①0~5 min内以COS(g)表示的反应速率v(COS)=_________________________________。
②若15 min末改变温度为T2℃,由表中数据变化判断T1__________(填“>”“<”或“=”)T2。
③若15 min末保持温度T1℃不变,向该容器中继续加入水蒸气和氧硫化碳各2 mol,重新达到平衡时,CO2(g)的物质的量___________________________(填字母)。
a.等于1.2 mol
b.等于2.4 mol
c.1.2 mol<n(CO2)<2.4 mol
d.大于2.4 mol
(2)实验测得:v正=k正·c(COS)·c(H2O),v逆=k逆·c(H2S)·c(CO2)(k正、k逆为速率常数)。若在2 L的密闭容器中充入1 mol COS和1 mol H2O,在T2℃温度下达到平衡时,k正∶k逆=__________。
三、多重平衡体系中平衡常数的计算
1.多重平衡体系:一个化学反应体系中存在多个化学反应,在一定条件下,这些反应都可以达到平衡状态,这种现象称作多重平衡现象,该体系称作多重平衡体系。
2.多重平衡反应类型
(1)连续型(耦合)反应:某物质是某反应的产物,同时又是其他反应的反应物。
(2)平行(竞争)型反应:某物质同时是多个反应的反应物。
3.多重平衡体系中有关平衡常数的计算,各组分的平衡量指的是整个平衡体系中的量,而不是指某一单一反应中的量。
例1 在1 L真空密闭容器中加入a mol PH4I固体,t℃时发生如下反应:
PH4I(s)PH3(g)+HI(g)①
4PH3(g)P4(g)+6H2(g)②
2HI(g)H2(g)+I2(g)③
达平衡时,体系中n(HI)=b mol,n(I2)=c mol,n(H2)=d mol,则t℃时反应①的平衡常数K

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享