

第4课时 温度、催化剂对化学平衡的影响 勒夏特列原理
[核心素养发展目标] 1.通过实验论证说明温度的改变和催化剂对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型。2.理解勒夏特列原理,能依据原理分析平衡移动的方向,体会理论对实践的指导作用。
一、温度、催化剂对化学平衡的影响
1.实验探究温度对化学平衡的影响
(1)常温下,反应2NO2(g)(红棕色)N2O4(g)(无色) ΔH=-56.9 kJ·mol-1达到平衡,按图示装置实验,观察实验现象,填写下表:
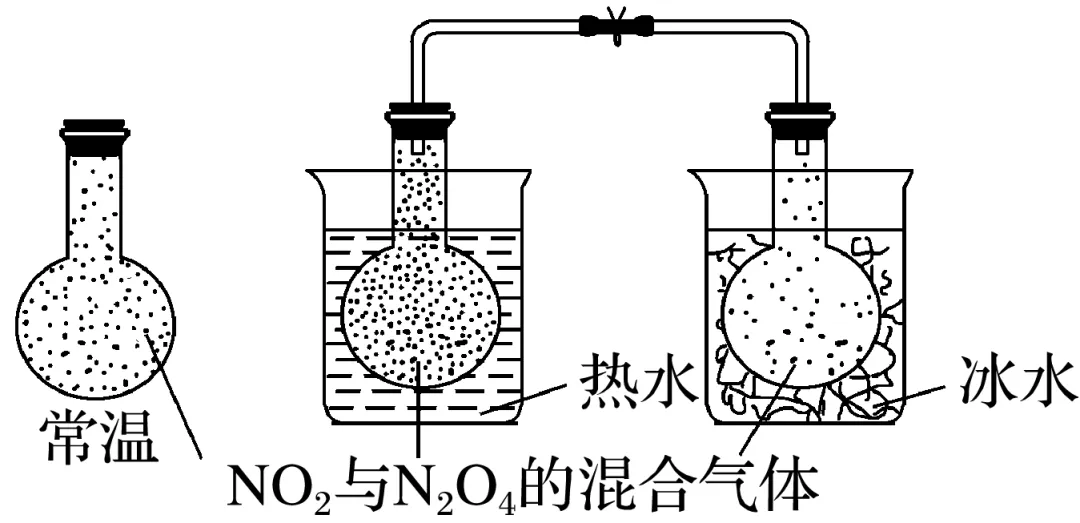
| 热水中 | 冰水中 |
实验现象 | 混合气体颜色______ | 混合气体颜色________ |
实验结论 | 说明NO2浓度______,平衡向________方向移动,即升高温度,平衡向________反应的方向移动 | 说明NO2浓度______,平衡向______方向移动,即降低温度,平衡向________反应的方向移动 |
(2)从温度对平衡常数K影响的角度解释上述实验平衡的移动方向:
该反应为放热反应,升高温度,K________,平衡________移动;降低温度,K________,平衡________移动,与实验结论一致。
2.温度对化学平衡的影响规律
(1)改变温度,任意可逆反应的化学平衡一定会发生移动。
(2)当其他条件不变时,升高温度,化学平衡向________的方向移动;降低温度,化学平衡向________的方向移动。
3.催化剂对化学平衡的影响规律
(1)催化剂能同等程度的改变____________反应速率。其图像(v-t图)如图。
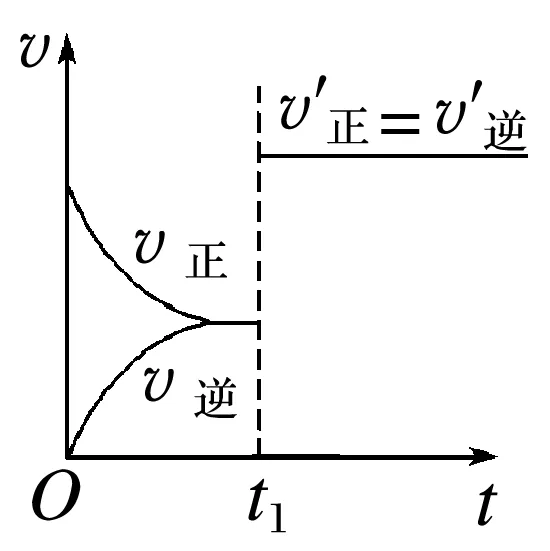
(2)当其他条件不变时,催化剂__________改变达到化学平衡状态时反应混合物的组成,催化剂能改变反应达到化学平衡所需的________。

(1)温度可以影响任意可逆反应的化学平衡状态( )
(2)升高温度,反应速率加快,化学平衡向正反应方向移动( )
(3)升高温度,反应速率加快,但反应物的转化率可能降低( )
(4)升高温度,化学平衡常数一定增大( )
(5)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( )
(6)平衡移动,平衡常数不一定改变,但平衡常数改变,平衡一定发生移动( )
(7)催化剂能加快反应速率,提高物质单位时间内的产量,也能提高反应物的转化率( )

1.一定条件下,在密闭容器中,发生反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0,达平衡后:
(1)容积不变,升高温度,平衡________移动,c(CO2)________,氢气的转化率________,CO的体积分数________,混合气体的平均相对分子质量________。
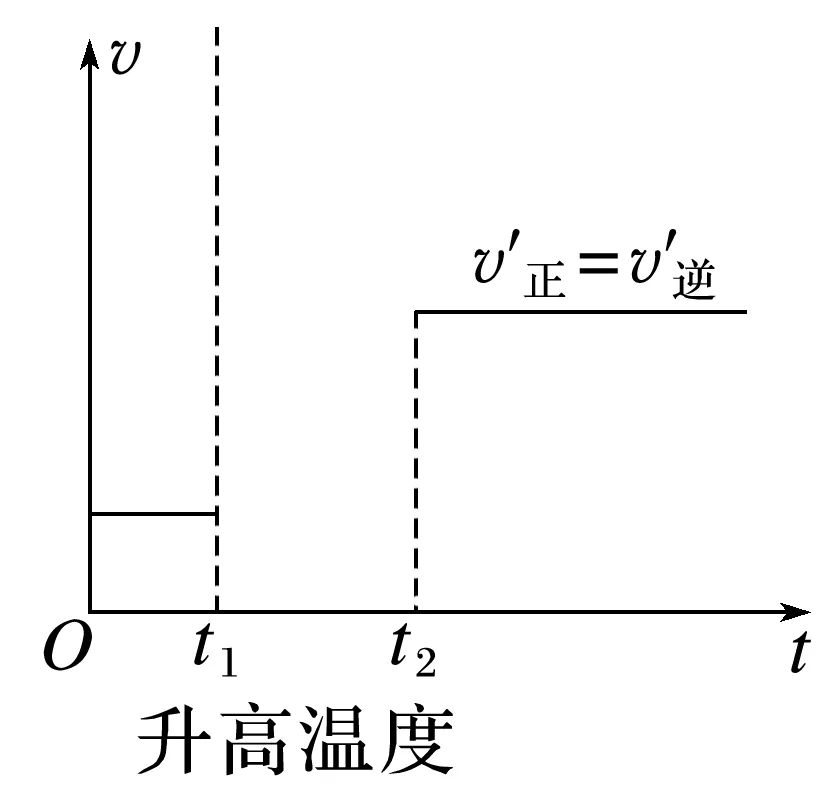
(2)在下图中补全,t1时,升高温度后的v-t图像。
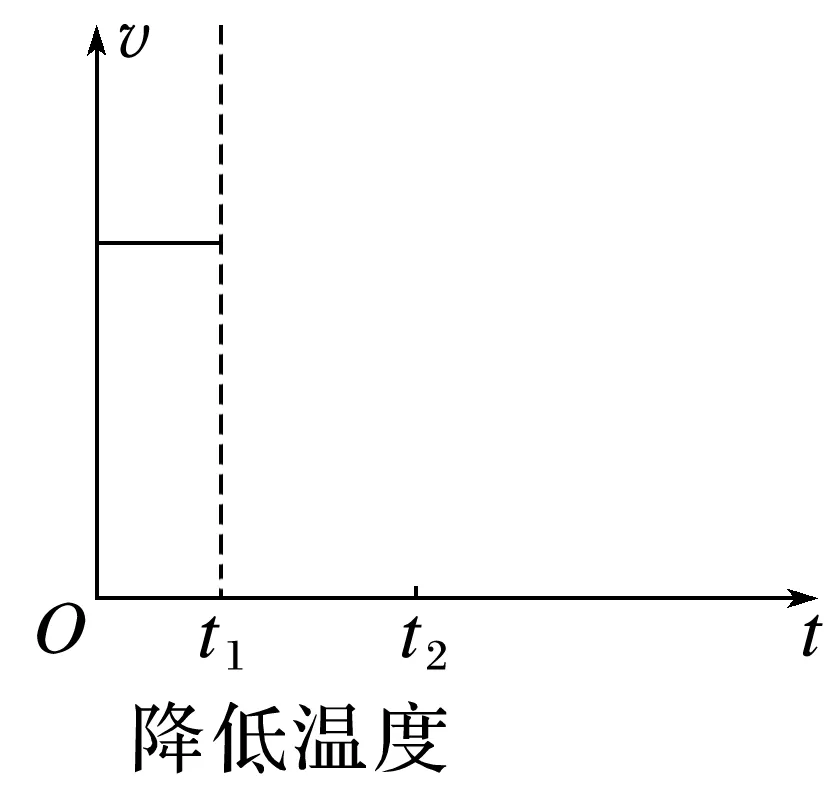
(3)在下图中画出,t1时,降低温度,t2时重新达到平衡的v-t图像。
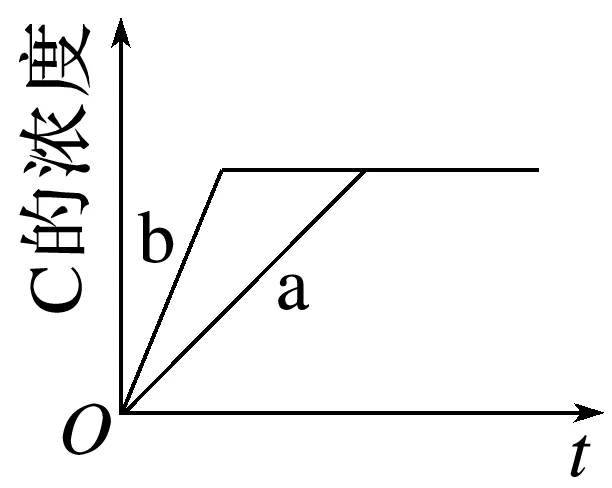
2.已知某可逆反应在密闭容器中进行:A(g)+B(g)3C(g)+D(s) ΔH>0,C的浓度与时间t的关系如图所示。若使a曲线变为b曲线,可能采取的措施是________________。
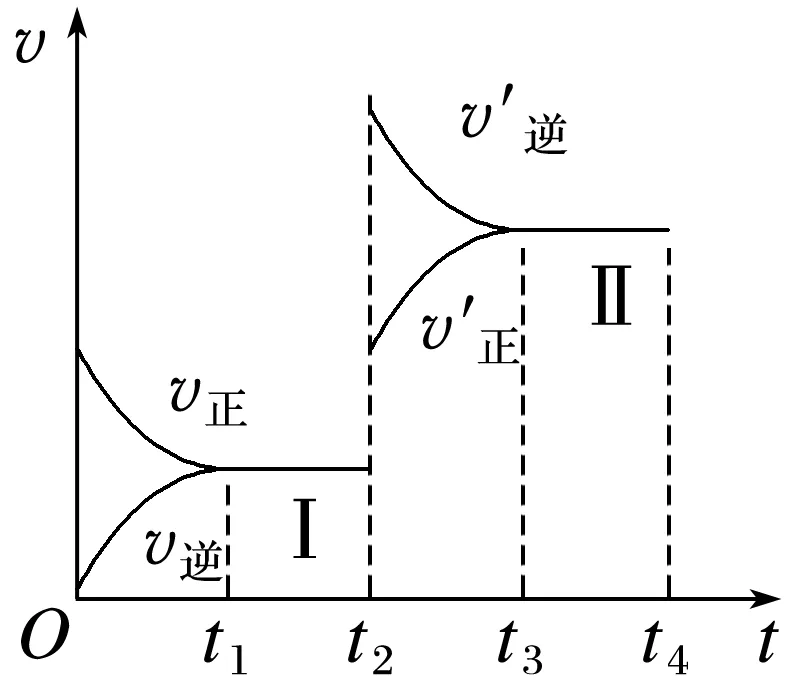
3.向一密闭容器中充入N2和H2发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,t1时刻达到平衡状态 Ⅰ,t2时刻改变某一条件,t3时刻重新达到平衡
状态 Ⅱ,反应速率(v)随时间(t)的变化如图所示。下列说法正确的是( )
A.t1时,v正(N2)=2v逆(NH3)
B.t2时改变的条件:向容器中加入NH3(g)
C.N2的平衡转化率:α(Ⅰ)>α(Ⅱ)
D.平衡常数K:K(Ⅰ)<K(Ⅱ)
4.羧基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在容积不变的密闭容器中充入2 mol CO和2 mol H2S发生反应:CO(g)+H2S(g)COS(g)+H2(g) ΔH,平衡时COS的体积分数随温度的变化如图所示。下列说法正确的是( )
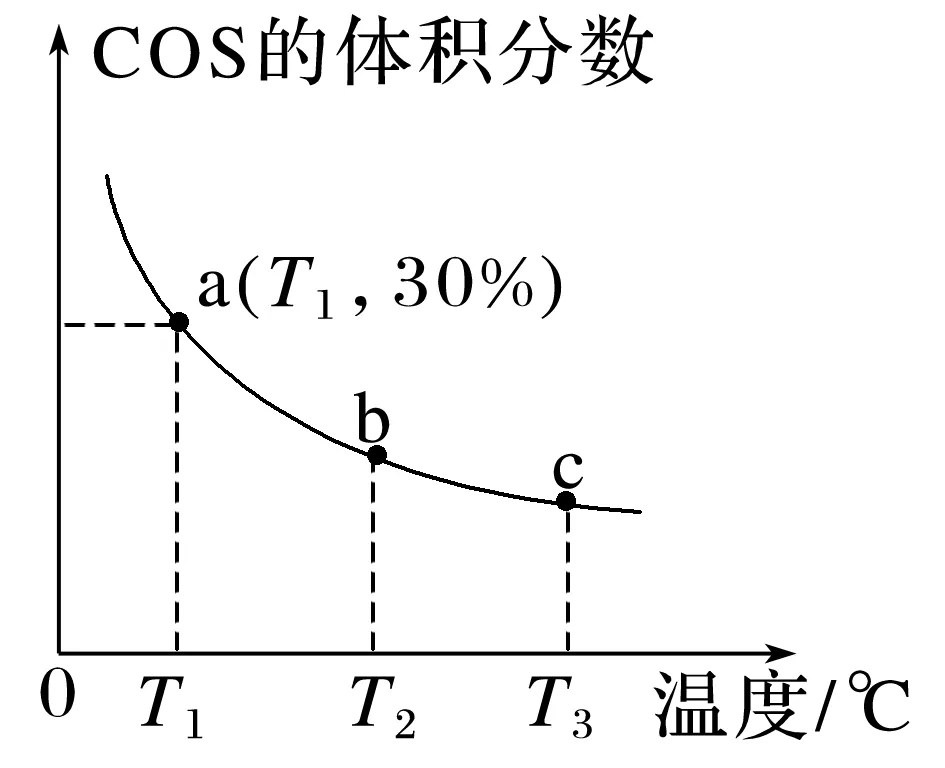
A.ΔH>0
B.T1℃,CO的平衡转化率为70%
C.a点正反应速率小于b点逆反应速率
D.增大压强可使COS的体积分数由c点增加到b点
二、勒夏特列原理
1.外因对化学平衡的影响
条件的改变(其他条件不变) | 化学平衡的移动 |
浓度 | 增大反应物浓度或减小生成物浓度 | 向________方向移动 |
减小反应物浓度或增大生成物浓度 | 向________方向移动 |
压强(对有气体参加的反应) | 反应前后气体分子数改变 | 增大压强 | 向________的方向移动 |
减小压强 | 向________的方向移动 |
反应前后气体分子数不变 | 改变压强 | |
温度 | 升高温度 | 向________反应方向移动 |
降低温度 | 向________反应方向移动 |
催化剂 | 使用催化剂 | |
| | | |
2.勒夏特列原理
(1)内容:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够________这种改变的方向移动。
(2)适用范围
勒夏特列原理适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可逆过程均不能使用该原理。
(3)对原理中“减弱这种改变”的理解
勒夏特列原理中的“减弱”不等于“消除”,更不是“扭转”。如,对于2NO2(g)(红棕色)N2O4(g)(无色)的平衡体系,若缩小体积增大压强,混合气体颜色先________,后________,达到新的平衡后混合体系颜色比原平衡时颜色____。

1.下列事实中,不能用勒夏特列原理解释的是______(填字母)。
A.溴水中存在如下平衡:Br2+H2OHBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于2H2O22H2O+O2的反应,使用MnO2可加快制备O2的反应速率
C.反应:CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,升高温度,平衡向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
E.H2(g)+I2(g)2HI(g),缩小体积加压颜色加深
2.(2023·乌鲁木齐高二月考)可逆反应A(g)+2B(g)2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化情况(填“增大”“减小”或“不变”)填入空格:
(1)升高温度:v正________,v逆__________,B的转化率__________。
(2)使用催化剂,v正________,v逆________,A的物质的量____________。
(3)保持温度和压强不变通入Ne气,则C的物质的量______,A的转化率________。
(4)保持温度和容积不变通入稀有气体,则A的转化率____________。
(5)若温度和容积不变,反应从正反应开始至平衡,在这个变化过程中,容器内气体的密度________。
3.在一密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2)=1 mol·L-1,容器内压强为p,温度为T。
(1)再向容器中通入N2,使其浓度变为2 mol·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是___________________________________。
(2)将容器体积缩小至平衡时的一半,并保持温度不变,再次达到平衡时压强p′的范围是________________________________________________________________________。
(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是________________________________________________________________________。
4.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得C的浓度为0.50 mol·L-1。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90 mol·L-1。
(1)压缩容积时,平衡是否发生移动?移动的方向如何?
________________________________________________________________________________________________________________________________________________________________
(2)C的体积分数__________(填“增大”“减小”或“不变”)。
(3)x+y________z(填“>”“<”或“=”)。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享