【学习笔记】盘点治疗性重组蛋白Linker中的那些翻译后修饰
- 2026-02-12 17:25:29
近些年来,生物药开发如火如荼,批准的治疗性重组蛋白的数量越来越多。与此同时,科学家们也在努力对蛋白进行工程化改造,以提高其功效和选择性,改变其结合特性,效价和药代动力学行为,并提高重组蛋白的安全性和降低免疫原性。
在治疗性重组蛋白中,除了常见的单抗外,还有一些蛋白的衍生物,如scFv、 Fab、双抗和融合蛋白等。这些变体通常需要linker来连接不同的结构域。常见的linker是多肽的重复序列,比如(G4S)n。(G4S)n也因其柔性和抗酶切的性质而成为一种常用的linker。
在使用linker构造新的重组蛋白的时候,需要测试每种重新设计的蛋白的亲和力和生物活性,以及翻译后修饰(PTM)的存在,包括接头区域中的任何修饰。今天就来盘点一下重组蛋白药物linker中的翻译后修饰、它们的发现过程及可能的消除及降低策略。
1.GGGGS linker中的翻译后修饰
木糖修饰
Biogen的研究人员首次报道了(G4S)nlinker中的木糖修饰,修饰位点为G4S中的S。研究人员还总结了以下发现:
(1)木糖基化是(G4S)n>2 linker中常见的PTM;
(2)GSG是木糖基化的motif;
(3)每个linker的木糖基化总量随着接头中GSG motif数量的增加而增加。
首先让我们来看一下分子的结构,在抗体重链的C端连了一个ScFv,一种比较常见的双抗形式。
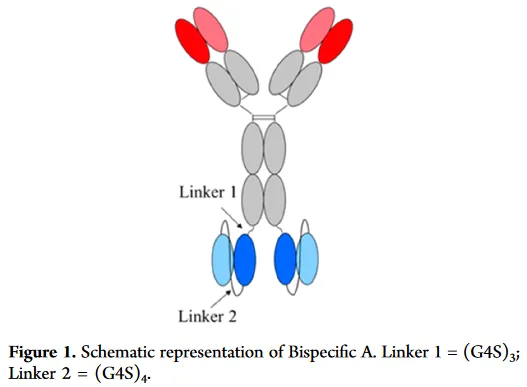
在对这一双抗进行脱糖还原分析的时候,发现重链除了目的峰外,还有一个+132Da的峰。
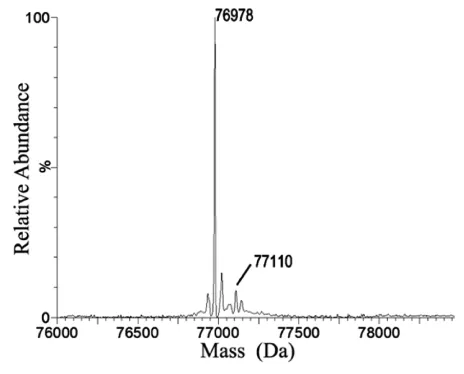
研究人员通过肽图分析,确认了含有G4S linker的一段多肽部分有+132Da。但是在二级解析的时候并没有看到这个多132Da峰对应的碎片峰,因此推测可能是戊糖修饰(糖苷键比肽键键能小,CID碎裂时会优先断裂糖苷键导致修饰无法看到)。
自然界中有三种常见的戊糖,分别是木糖(仅在植物和细菌中发现过)、核糖和阿拉伯糖。上述戊糖修饰是哪一种呢?通过酸水解将戊糖从蛋白上释放下来,然后用2-AA衍生,将其与三种常见戊糖的2-AA衍生标准品比较,发现这个戊糖是木糖(图中只有B木糖和C核糖的标准品,并没有阿拉伯糖的,奇怪是不是漏掉了)。当然他们还比较分析了2-AA衍生后三种戊糖的二级碎片,发现双抗中释放下来的戊糖和标准品木糖的是一致的,进一步得到了确证。
至于木糖的修饰位点,前面提到,CID碎裂是无法看到修饰位点的,因此使用温和的碎裂方式ETD才确认,修饰位点为含G4S linker肽段中的S。
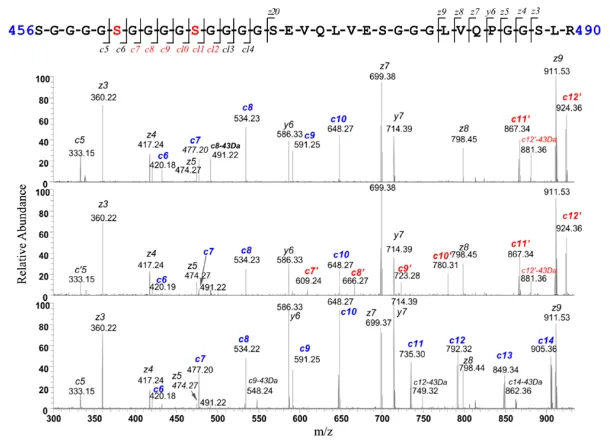
🔷含G4S linker蛋白中木糖修饰比例和哪些因素有关呢?
有报道发现,不同表达体系中木糖修饰比例有很大差异,HEK表达的分子中木糖修饰会比CHO细胞表达的高约10倍,我在做项目中分子表征的时候也有类似的发现。还有上面提到的G4S重复的个数,个数越多,修饰比例越高。
🔷如何消除木糖这一翻译后修饰呢?
木糖作为人体中不存在的一种糖,其存在可能会有引起免疫反应的风险。因此尽可能想办法减少或消除这一修饰。最直接的方法就是去掉能被修饰的S。还有就是把S改为其他氨基酸,例如A、P。另一个就是在S前面或后面加一个P,人为制造空间位阻,减少木糖转移酶与S接触的机会。
磷酸化修饰
在使用HEK细胞表达一个Fc融合蛋白的时候,Roche的研究人员发现了G4S linker中的磷酸化修饰。下面是他们蛋白分子的示意图。
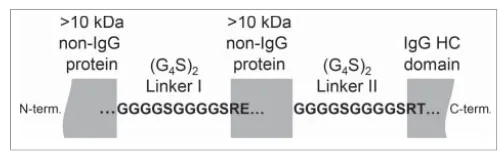
在对融合蛋白进行脱糖还原分析的时候,除了检测到上一部分讲到的木糖修饰外,还多出来一个加79Da的峰。含有+79Da的峰,之前在其他文章里讲到过,可能是磷酸化或硫酸化修饰。
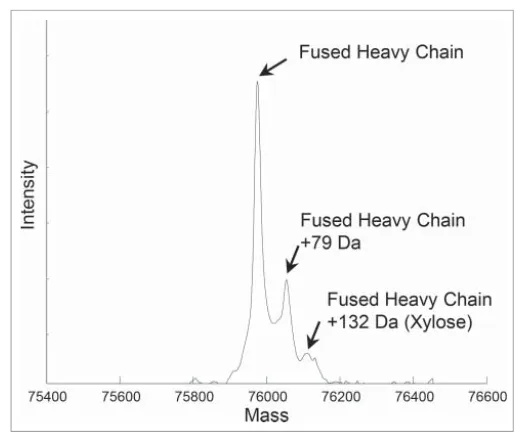
🔷怎么确认是磷酸化修饰呢?
(1)使用碱性磷酸酶处理,若+79Da的峰消失,则可以排除是硫酸化修饰
(2)合成含有磷酸化修饰的肽段,将其掺入含有天然修饰的样品中,若天然修饰的峰面积增加,则可确认是磷酸化修饰
至于修饰位点的确认,还是老一套,肽图分析。因为这个蛋白中有两个GS linker,在酶切用酶的选择上需要下一些功夫,最后使用 thermolysin酶切,确认了修饰位点在第一个GS linker1中。文中还提到了一个预测磷酸化修饰位点的网站(www.cbs.dtu.dk/services/NetPhos/),预测的结果也是GS linker1中的S磷酸化修饰的可能性更高,打分是0.97。
作者也比较了不同表达体系中磷酸化修饰的比例,发现CHO细胞表达蛋白磷酸化修饰比例小于1%。我在项目中也遇到过HEK细胞表达的蛋白出现+79Da的峰,也尝试用碱性磷酸酶处理,但是却没有发现这个峰消失。
🔷怎么降低含有G4S linker蛋白中磷酸化修饰的比例呢?
沈药的研究人员在细胞培养条件上进行了一些尝试。他们发现,半胱氨酸,维生素C,柠檬酸铁,和烟酰胺四种物质对于降低磷酸化修饰是重要的。增加维生素C、柠檬酸铁和烟酰胺补料速率以及降低半胱氨酸的补料速率有助于降低磷酸化水平。
糖胺聚糖(GAG)型O糖修饰
这一修饰在之前文章中讲过(案例分享016|重组蛋白中的另类O糖修饰),不再详述。
2.GGGGP linker中的脯氨酸羟化修饰
前面G4S linker修饰中提及的糖胺聚糖型O糖修饰是Amgen的研究人员发现的。前面也讲到G4S linker如何避免出现木糖修饰,其中有一个方法就是把S改为其他氨基酸,Amgen的研究人员在这一篇文章中就尝试了将S改为P。结果,让他们发现P也不行,还会带来羟化修饰。
这两篇文章中的分子应该是一样的,除了linker由G4S改为了G4P:在Fc的C端通过G4P linker连接了生长因子蛋白。在还原分析的时候,发现主峰后面有一个约+17Da的峰,且比例高达45%。
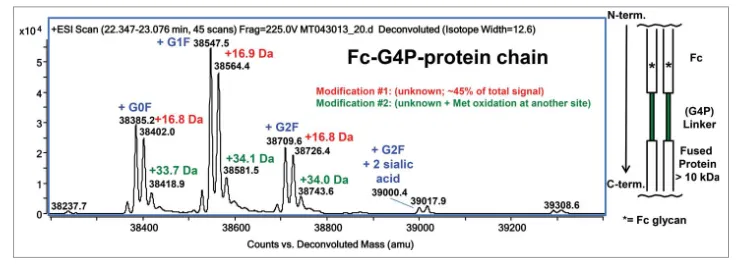
通过肽图分析,发现含有G4P linker的肽段含有较高比例的加16Da的峰(~40%)。
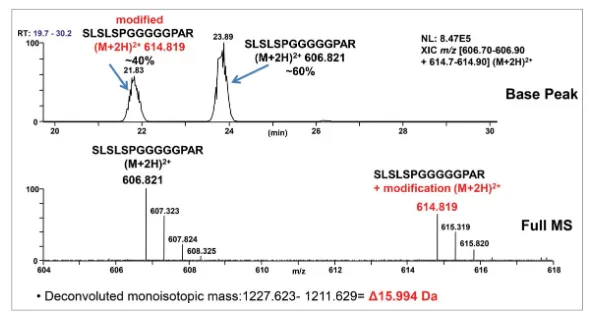
至于这一分子量增加是因为氨基酸突变引起还是氨基酸修饰引起,作者进行了大量的理论推理和实验验证。最后用高分辨率质谱仪及各种碎裂模式进行了确认:+16Da是脯氨酸羟化修饰,而不是氨基酸突变,并且修饰位点为G4P中的P。
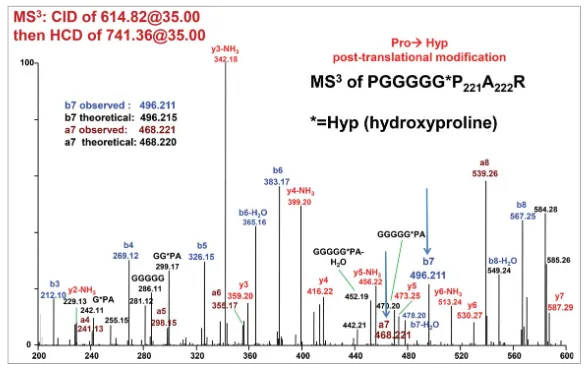
目前尚未有文献讨论将脯氨酸羟化作为CQA的可能性。羟脯氨酸本身就是一种天然氨基酸,因此不太可能具有免疫原性。但是,羟化的脯氨酸可能会改变蛋白的结构,影响融合蛋白的功能。因此,作者建议尽量避免使用脯氨酸羟化修饰比例高的linker。
3.IgG铰链区linker中的O糖修饰
有的时候,如果Fc融合蛋白是在N端,会直接借用IgG的铰链区作为linker。例如已经上市的阿巴西普(Abatacept)、贝拉西普(Belatacept)、阿柏西普(Aflibercept)、依那西普(Etanercept)等。
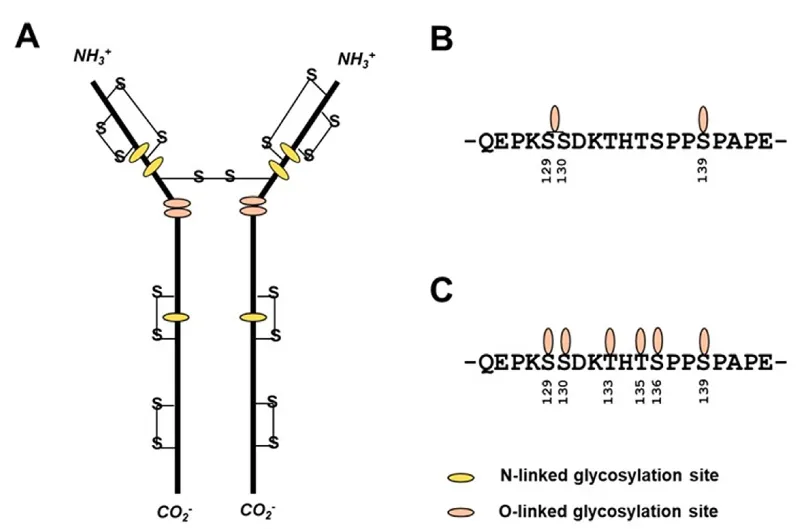
有研究发现,在抗体的铰链区不会发生O糖修饰,而被借用做linker的重组融合蛋白的铰链区却可能会发生O糖修饰。BMS的贝拉西普就是一个例子。从上图可以看到,这个铰链区也并非它本身的样子,而是CPPC被改成了SPPS。
为什么改成SPPS后O糖修饰就出现了呢?研究人员认为铰链区的高柔性使得糖基转移酶容易在这里对S和T进行O糖修饰,通过分子动态模拟也确认了这一点。
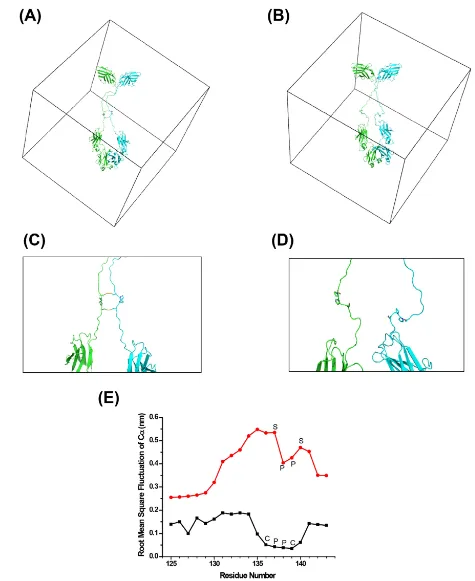
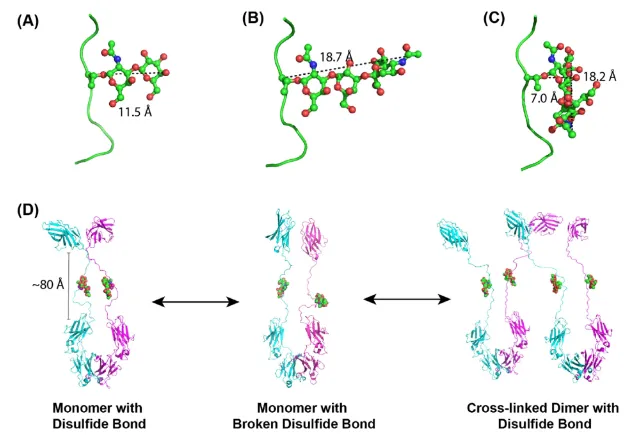
研究人员还发现O糖修饰导致的一个不好的结果是容易形成高聚体。可能的机理是还原型融合蛋白中的游离巯基可交联至另一还原型的融合蛋白,形成交联二聚体及多聚体,且因较大的O糖带来的空间位阻使得形成正确配对的单体变的更难。
写在后面
在做项目的时候,遇到了不少上面讲到的linker中的翻译后修饰,例如木糖修饰、糖胺聚糖修饰、磷酸化修饰等。在这里对重组蛋白linker中的修饰做一下盘点,各位同行若遇到其他的修饰可以在留言区评论,让更多同行了解,为促进我国生物医药的研发贡献自己的一份力量。
参考文献
1. Wen D, Foley SF, Hronowski XL, Gu S, Meier W. Discovery and investigation of O-xylosylation in engineered proteins containing a (GGGGS)n linker. Anal Chem. 2013 May 7;85(9):4805-12. doi: 10.1021/ac400596g.
2. Spencer D, Novarra S, Zhu L, Mugabe S, Thisted T, Baca M, Depaz R, Barton C. O-xylosylation in a recombinant protein is directed at a common motif on glycine-serine linkers. J Pharm Sci. 2013 Nov;102(11):3920-4.
3.Tyshchuk O, Völger HR, Ferrara C, Bulau P, Koll H, Mølhøj M. Detection of a phosphorylated glycine-serine linker in an IgG-based fusion protein. MAbs. 2017 Jan;9(1):94-103.
4. Hou Y, Su H, Luo Z, Li M, Ma X, Ma N. Nutrient Optimization Reduces Phosphorylation and Hydroxylation Level on an Fc-Fusion Protein in a CHO Fed-Batch Process. Biotechnol J. 2019 Mar;14(3):e1700706.
5. Spahr C, Shi SD, Lu HS. O-glycosylation of glycine-serine linkers in recombinant Fc-fusion proteins: attachment of glycosaminoglycans and other intermediates with phosphorylation at the xylose sugar subunit. MAbs. 2014 Jul-Aug;6(4):904-14.
6. Spahr C, Gunasekaran K, Walker KW, Shi SD. High-resolution mass spectrometry confirms the presence of a hydroxyproline (Hyp) post-translational modification in the GGGGP linker of an Fc-fusion protein. MAbs. 2017 Jul;9(5):812-819.
7. Song Y, Qian Y, Huang Z, Khattak SF, Li ZJ. Computational insights into O-glycosylation in a CTLA4 Fc-fusion protein linker and its impact on protein quality attributes. Comput Struct Biotechnol J. 2020 Dec 1;18:3925-3935.
8. Bongers J, Devincentis J, Fu J, Huang P, Kirkley DH, Leister K, Liu P, Ludwig R, Rumney K, Tao Li, Wu W, Russell RJ. Characterization of glycosylation sites for a recombinant IgG1 monoclonal antibody and a CTLA4-Ig fusion protein by liquid chromatography–mass spectrometry peptide mapping. J Chromatogr A 2011;1218(45):8140–9.
更多学习交流机会,请添加微信号入群交流。

