


第一节 原电池
第1课时 原电池的工作原理
[核心素养发展目标] 1.理解原电池的工作原理,能根据电极反应、电流方向或离子的移动方向判断原电池的正极和负极。2.能设计简单的原电池并能理解原电池工作原理的应用。
一、原电池的工作原理
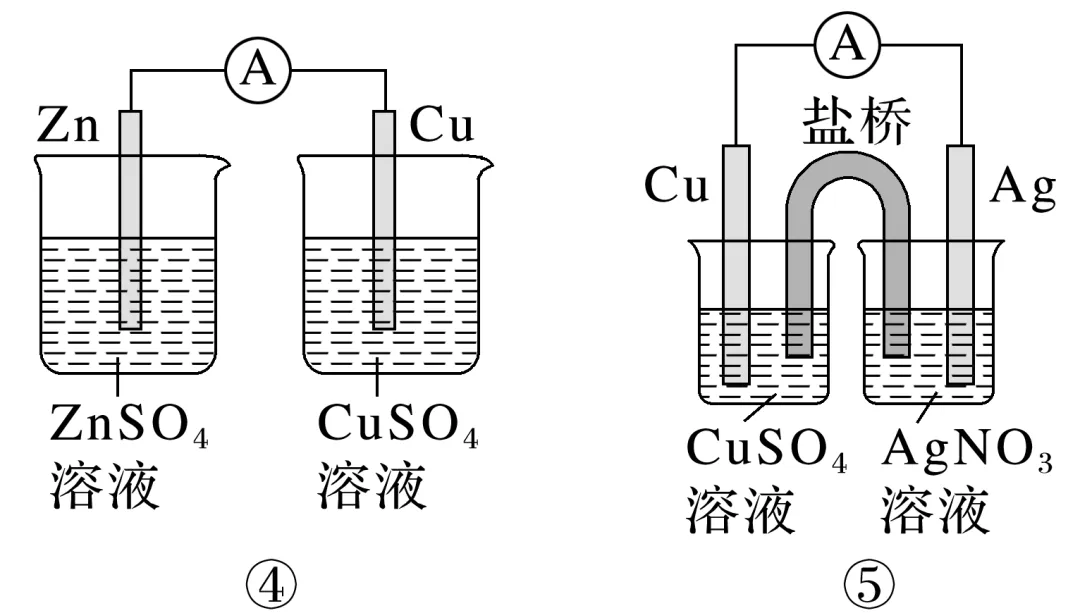
1.实验探究含盐桥的锌铜原电池的工作原理
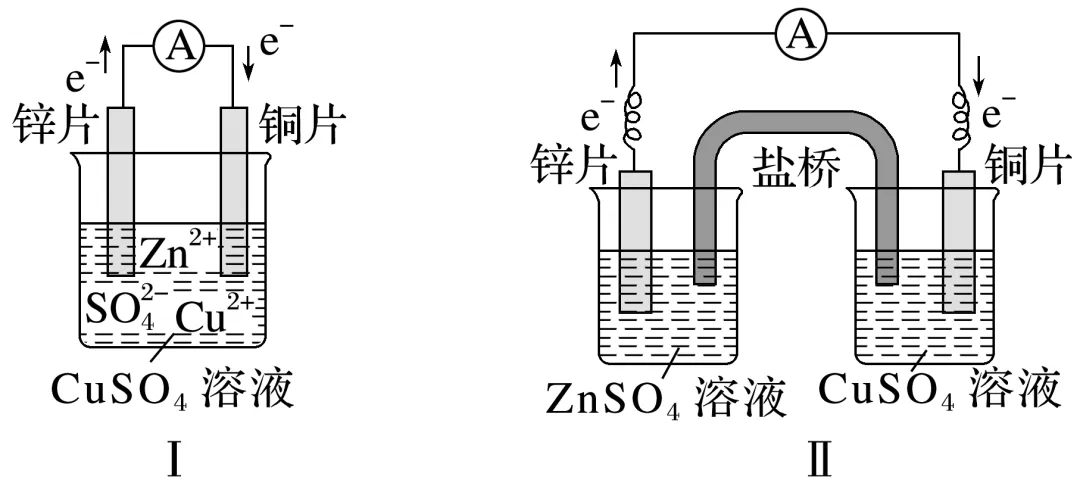
(1)实验现象:两种电池均产生电流,锌片________,铜片上________________,电流表指针发生________。
(2)实验结论:两种装置均能构成原电池,将化学能转化成电能。
(3)分析上述原电池的工作原理
| 负极 | 正极 |
电极材料 | | |
电极反应 | | |
反应类型 | ________反应 | ________反应 |
电池总反应 | | |
电子流向 | 由____极通过导线流向____极 |
离子移向 | 阳离子移向____极,阴离子移向____极 |
(4)根据以上实验探究回答下列问题:
①盐桥(装有含KCl饱和溶液的琼脂)中离子移动方向:________移向ZnSO4溶液,________移向CuSO4溶液。盐桥在原电池装置中的作用是_____________________________________。
②对比图Ⅰ与图Ⅱ两装置,能更有效地将化学能转化为电能的是________,其原因是________________________________________________________________________
________________________________________________________________________。
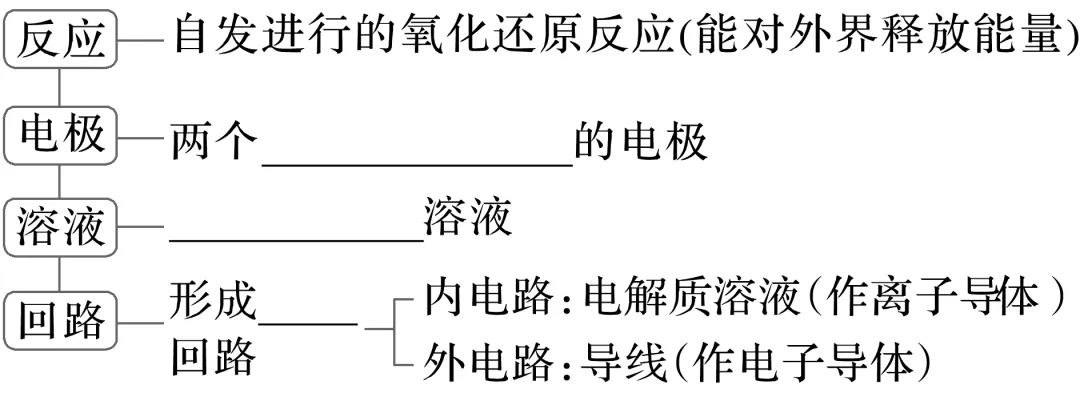
2.原电池
(1)定义:把________能转化为____能的装置。
(2)构成条件

(1)理论上,任何的氧化还原反应都可设计成原电池( )
(2)在原电池中,发生氧化反应的一极一定是负极( )
(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(4)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高( )
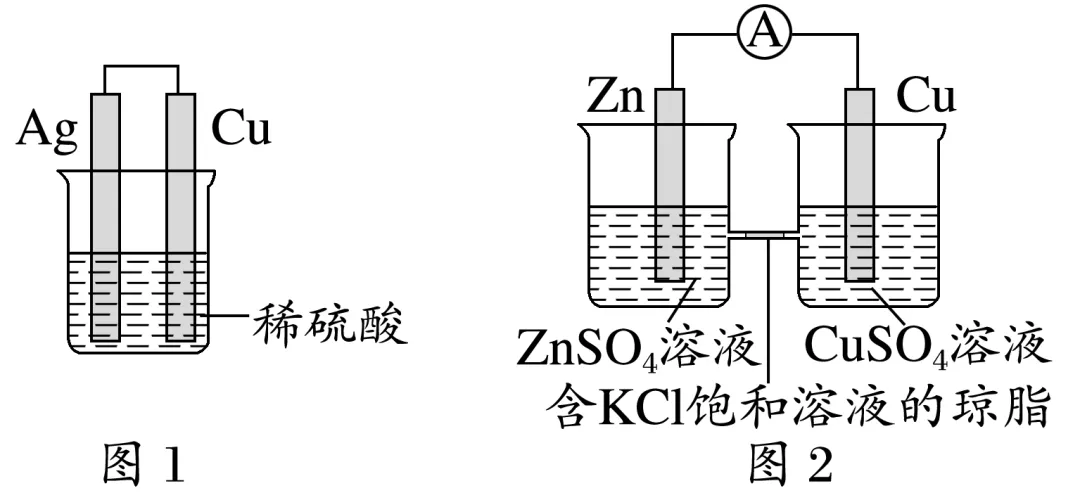
(5)利用图1能实现Cu+H2SO4===CuSO4+H2↑( )
(6)图2能验证锌与硫酸铜反应过程中有电子转移( )

(1)下列反应理论上能设计成原电池的是__________(填序号)。
①HCl+NaOH===NaCl+H2O ΔH<0
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH<0
③4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH<0
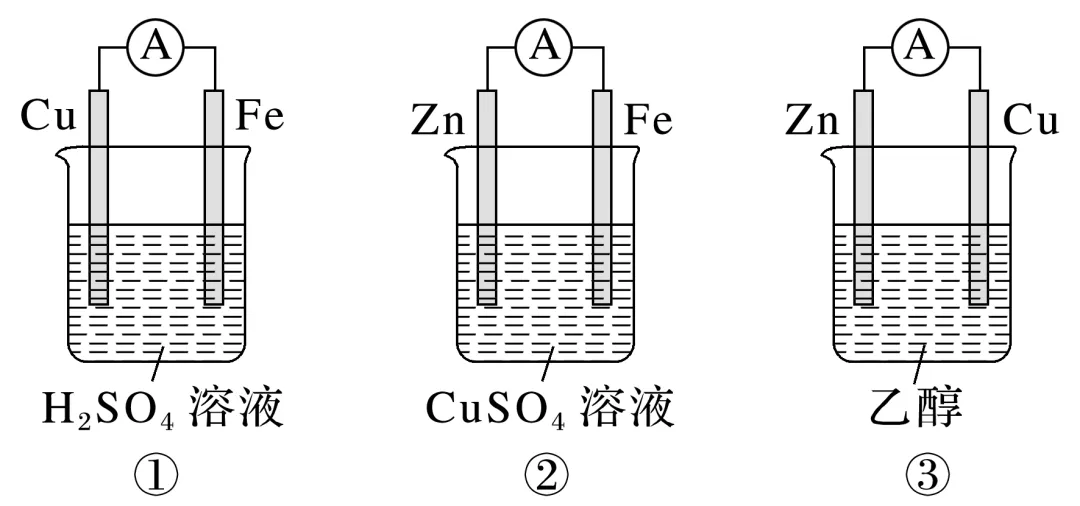
(2)下列装置中,能构成原电池的是______(填序号),能构成原电池的指出电极的名称并写出电极反应式。
________________________________________________________________________________
________________________________________________________________________________

原电池中正、负极的判断
判断依据 | 负极 | 正极 |
电子流动方向 | 电子流出极 | 电子流入极 |
电解质溶液中阴、阳离子定向移动的方向 | 阴离子移向的电极 | 阳离子移向的电极 |
电流方向 | 电流流入极 | 电流流出极 |
两极发生的反应 | 失电子,发生氧化反应 | 得电子,发生还原反应 |
电极材料 | 一般是活动性较强的金属 | 活动性较弱的金属或能导电的非金属 |
二、原电池工作原理的应用
1.加快化学反应速率
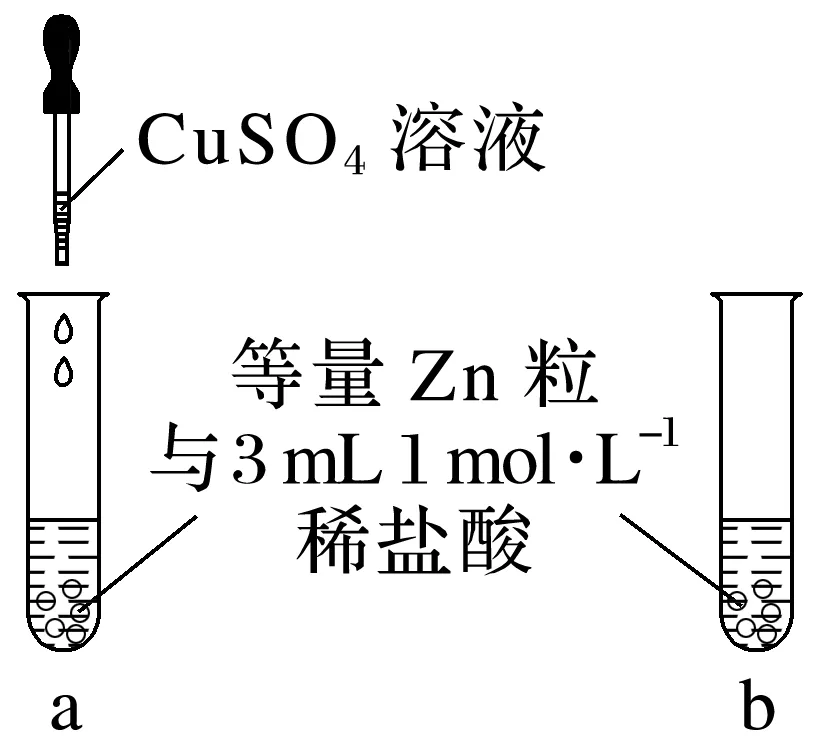
当试管a中滴入少量CuSO4溶液后,观察到其中产生气泡的速率较试管b中的________,其原因是________________________________________________________________________
________________________________________________________________________。
2.比较金属的活动性强弱
原电池的两极为两种不同金属时,一般作负极的金属比作正极的金属活泼(注意电解质溶液的种类)。
3.设计原电池的一般思路
首先将氧化还原反应拆分成氧化反应和还原反应两个半反应。
其次确定正、负极选择电极材料,还原剂(一般为比较活泼的金属)为负极,比较不活泼的金属或惰性电极为正极。
最后用导线连接两个电极并插入电解质溶液形成闭合回路,如果两个半反应分别在两个容器中进行,中间应用盐桥连接。

1.某单液原电池的总反应为Cu+2Ag+===Cu2++2Ag,下列关于该反应的电池设计正确的是( )
A.正极材料为Cu,电解质溶液为CuCl2
B.负极材料为Ag,电解质溶液为AgNO3
C.正极材料为C,电解质溶液为AgNO3
D.负极材料为Cu,电解质溶液为CuSO4
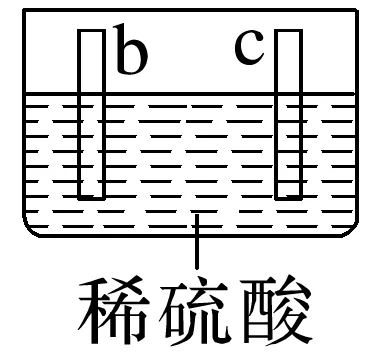
2.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 | 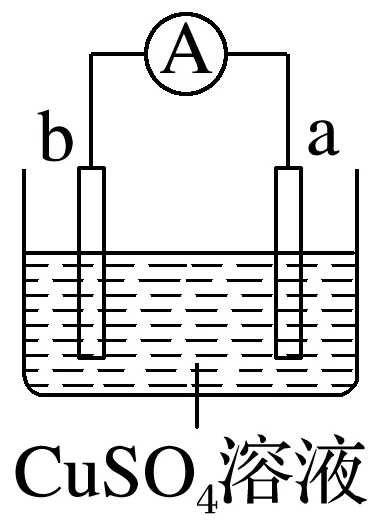
| 
| 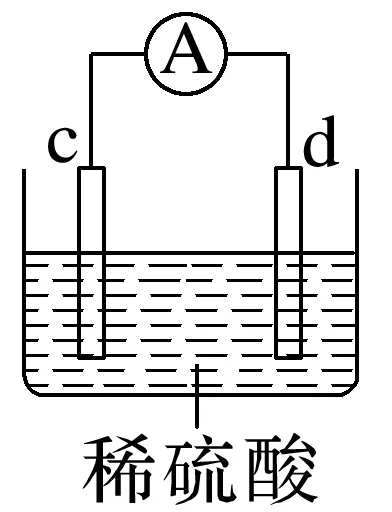
| 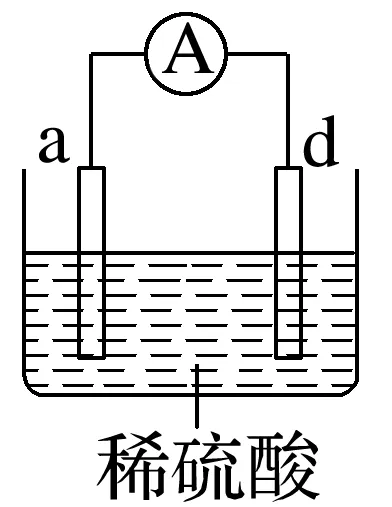
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是____________。
3.利用反应2FeCl3+Cu===2FeCl2+CuCl2,设计一个原电池装置。
(1)在下图方框中画出两种原电池装置图,标明电极材料和电解质溶液。
单液原电池装置图
带盐桥的双液原电池装置图
(2)写出电极反应式。
负极:________________________________________________________________________。
正极:________________________________________________________________________。
4.某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1稀硫酸中,乙同学将电极放入6 mol·L-1 NaOH溶液中,如图所示。
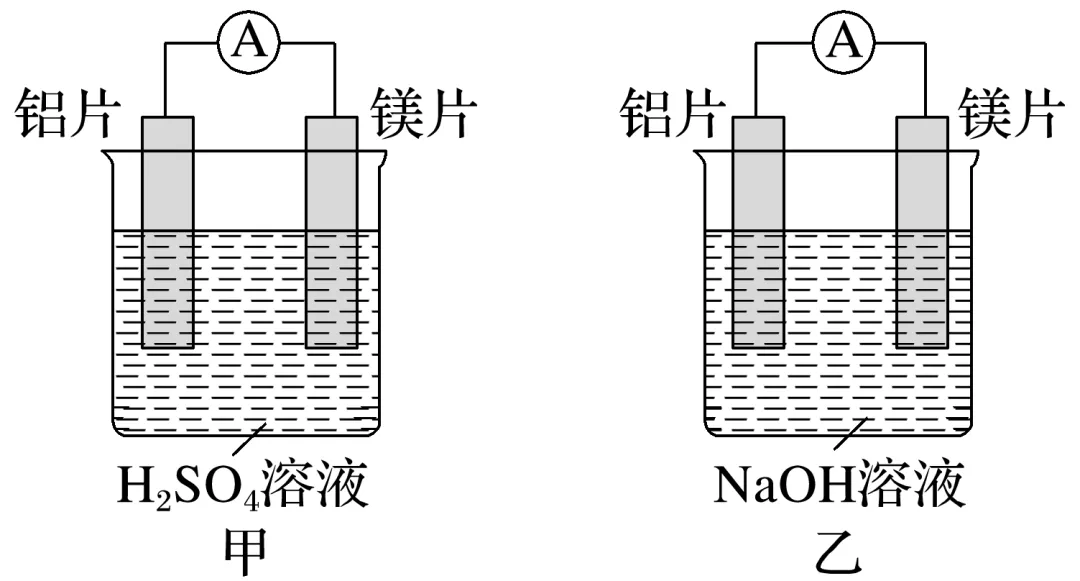
(1)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__________(填写元素符号,下同)活动性更强,而乙会判断出________活动性更强。
由此实验,可得到的结论是_______________________________________________________。
(2)上述实验也反过来证明了“利用金属活动性顺序直接判断原电池中正、负极”的做法__________(填“可靠”或“不可靠”)。如不可靠,则请你提出另一个判断原电池正、负极可行的实验方案:______________________________________________________________
______________________________________________________________________________。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享