


第一节 反应热
第1课时 反应热 焓变
[核心素养发展目标] 1.理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。2.能从宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应。3.能辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变的概念。
一、反应热及相关概念
1.体系与环境(以盐酸与NaOH溶液的反应为例)

2.热量
因温度不同而在________与________之间________________。
3.吸热反应和放热反应
有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应 ②大多数的分解反应 ③大多数的化合反应 ④铝热反应
⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧 ⑧金属与酸的置换反应
其中属于放热反应的是______________(填序号,下同),属于吸热反应的是________。
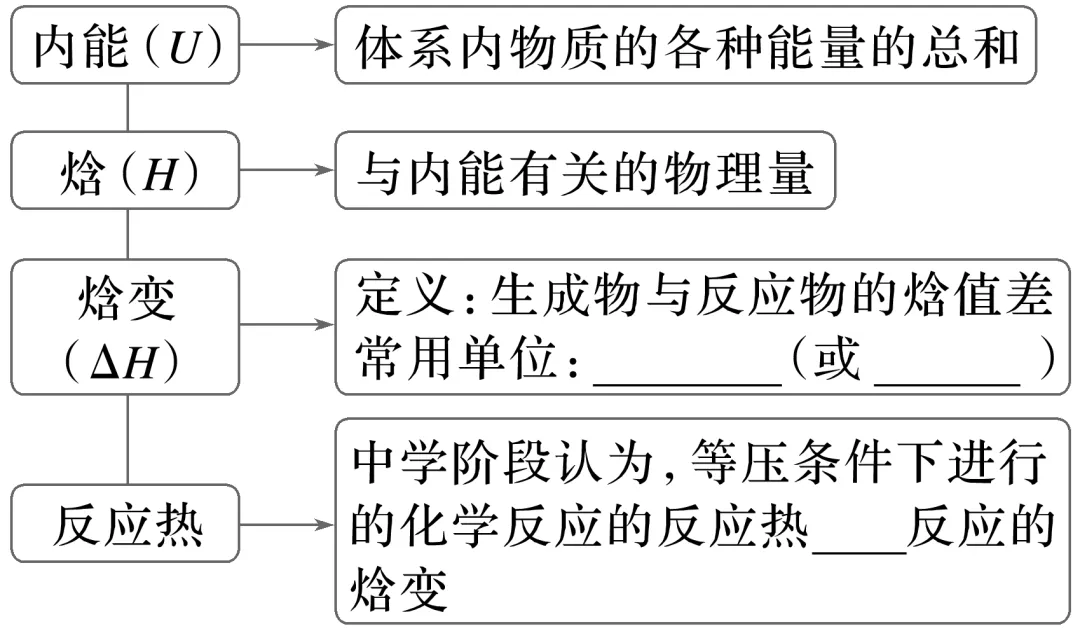
4.反应热
反应热概念:在等温条件下,化学反应体系向环境___________或从环境__________的____________,称为化学反应的热效应,简称_______意义:定量的描述化学反应过程中释放或吸收的_______反应热的测定:在环境温度不变的条件下,许多反应热可通过量热计测定体系反应前后温度的差值,应用有关物质的比热容等计算反应热

(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )
(2)浓硫酸溶于水是放热反应( )
(3)锌与稀硫酸反应导致体系温度升高,且向环境中释放热量( )
(4)物质发生化学变化都伴有能量的变化( )
二、中和反应反应热的测定
1.测定原理
环境温度不变时,根据测得的体系的温度变化和有关物质的比热容等来计算反应热:Q=____________。
2.实验装置
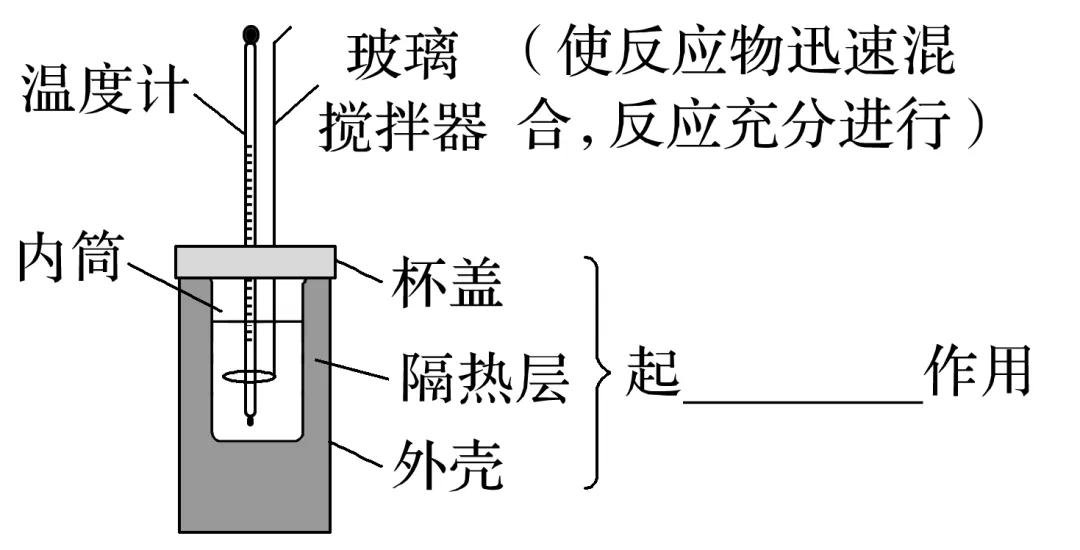
3.实验操作步骤
(1)反应前体系的温度:分别测量盐酸与NaOH溶液的温度。
(2)反应后体系的温度:________混合并________,记录________温度。
(3)重复操作两次,取温度差的________作为计算依据。

| 问题 | 分析 |
药品用量 | (1)为什么采用碱稍过量的方法? | |
实验装置仪器选择 | (2)能否用金属搅拌器代替玻璃搅拌器? | |
(3)测量盐酸和NaOH溶液的温度时能否选用不同的温度计? | |
实验操作 | (4)测完酸后能否直接测量碱的温度?应该如何操作? | |
(5)将溶液迅速倒入内筒后,为什么要立即盖上杯盖? | |
(6)能否将NaOH溶液分多次倒入量热计中? | |
4.数据处理
某化学小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验。
实验次数 | 反应物的温度/℃ | 反应前体系的温度/℃ | 反应后体系的温度/℃ | 温度差/℃ |
盐酸 | NaOH溶液 | t1 | t2 | (t2-t1) |
1 | 25.0 | 25.2 | | 28.5 | |
2 | 24.9 | 25.1 | | 28.3 | |
3 | 25.6 | 25.4 | | 29.0 | |
取三次测量所得温度差的平均值作为计算依据(注意误差太大的数据要舍去)。
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1,反应放出的热量Q=cmΔt=c·[m(盐酸)+m(NaOH溶液)]·(t2-t1)≈________ kJ,生成1 mol H2O放出的热量为QnH2O=________=________。
特别提醒 大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。

(1)本次实验测得数据小于57.3 kJ·mol-1,试分析产生误差可能的原因。
________________________________________________________________________
________________________________________________________________________
(2)若改用100 mL 0.50 mol·L-1的盐酸与100 mL 0.55 mol·L-1 NaOH溶液混合,所测中和反应反应热的数值是否为本实验结果的2倍?
________________________________________________________________________
________________________________________________________________________
(3)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
________________________________________________________________________
________________________________________________________________________
(4)若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,测得的数值________(填“>”“<”或“=”)57.3 kJ·mol-1。
三、反应热与焓变
1.焓和焓变 反应热与焓变的关系
2.反应热产生的原因分析
(1)从反应体系始末状态的能量视角分析
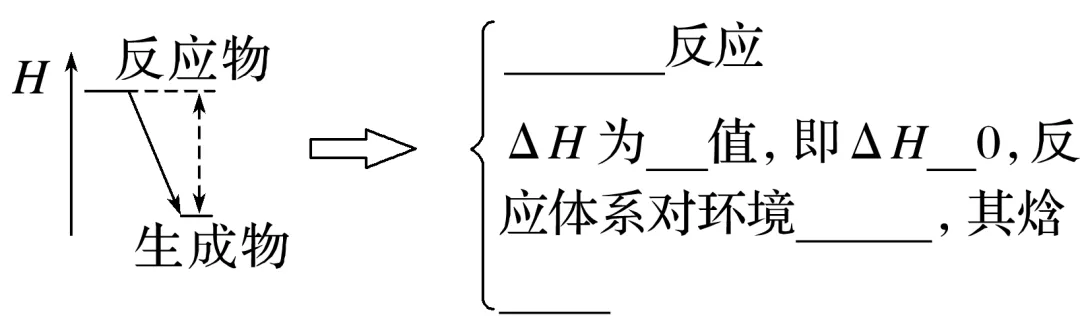
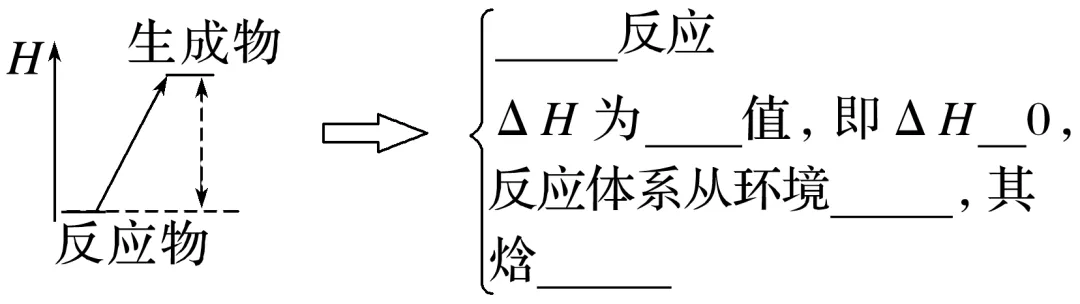
ΔH=________总能量-________总能量。
(2)从微观化学反应过程化学键的变化视角分析
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明,如图所示:
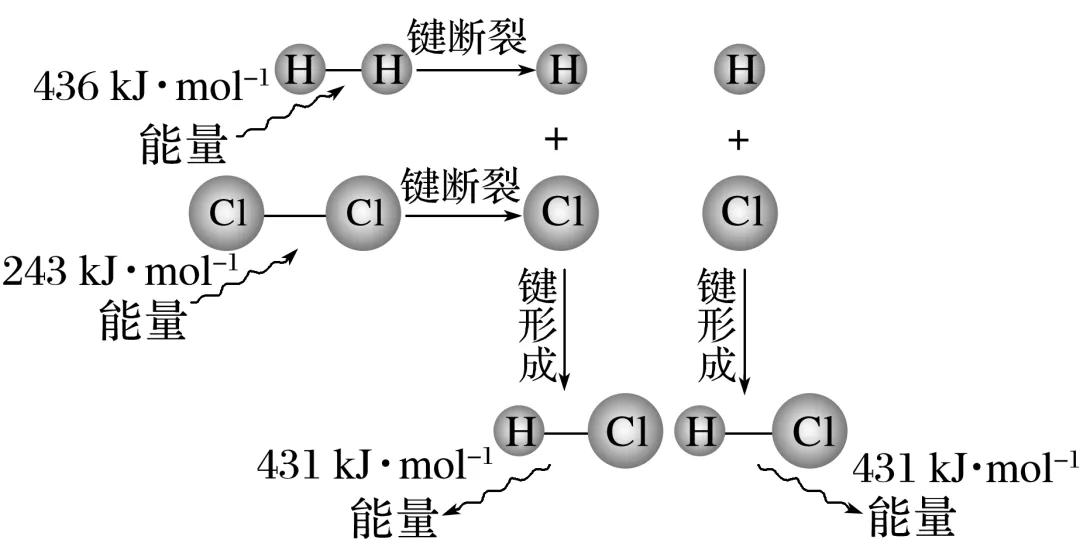
ΔH=________________________________________________________________________
________________________________________________________________________。
计算结果表明:1 mol H2与1 mol Cl2反应生成2 mol HCl时,____________________________的能量。

(1)ΔH的单位采用kJ·mol-1时,表示1 mol反应的焓变( )
(2)NaOH溶液与稀硫酸反应的ΔH>0( )
(3)一个化学反应,当反应物的总能量大于生成物的总能量时,反应放热,ΔH<0( )
(4)化学反应中能量变化的多少与反应物的质量无关( )
(5)吸热反应中,反应物化学键断裂吸收的总能量高于生成物化学键形成放出的总能量( )

1.某化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列有关叙述不正确的有__________(填字母)。
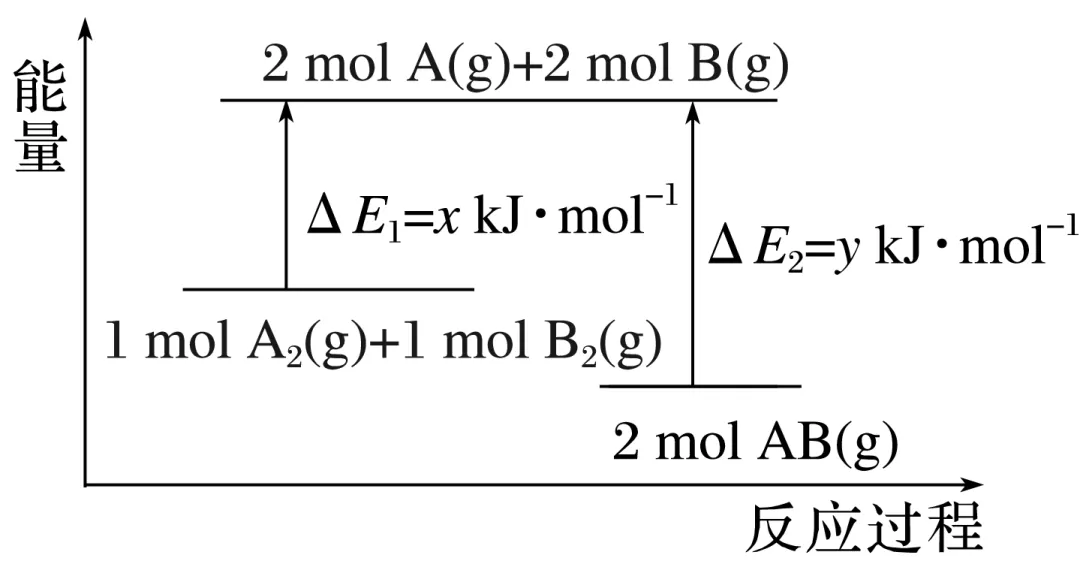
A.该反应为放热反应,无需加热就可以发生
B.断裂1 mol A—A和1 mol B—B要吸收x kJ的能量
C.根据图示可知生成1 mol AB (g)放出(y-x)kJ的能量
D.三种物质A2(g)、B2(g)、AB(g)中,最稳定的物质一定是AB(g)
2.已知:H2(g)+12O2(g)===H2O(g),反应过程中的能量变化如图所示,回答下列问题。
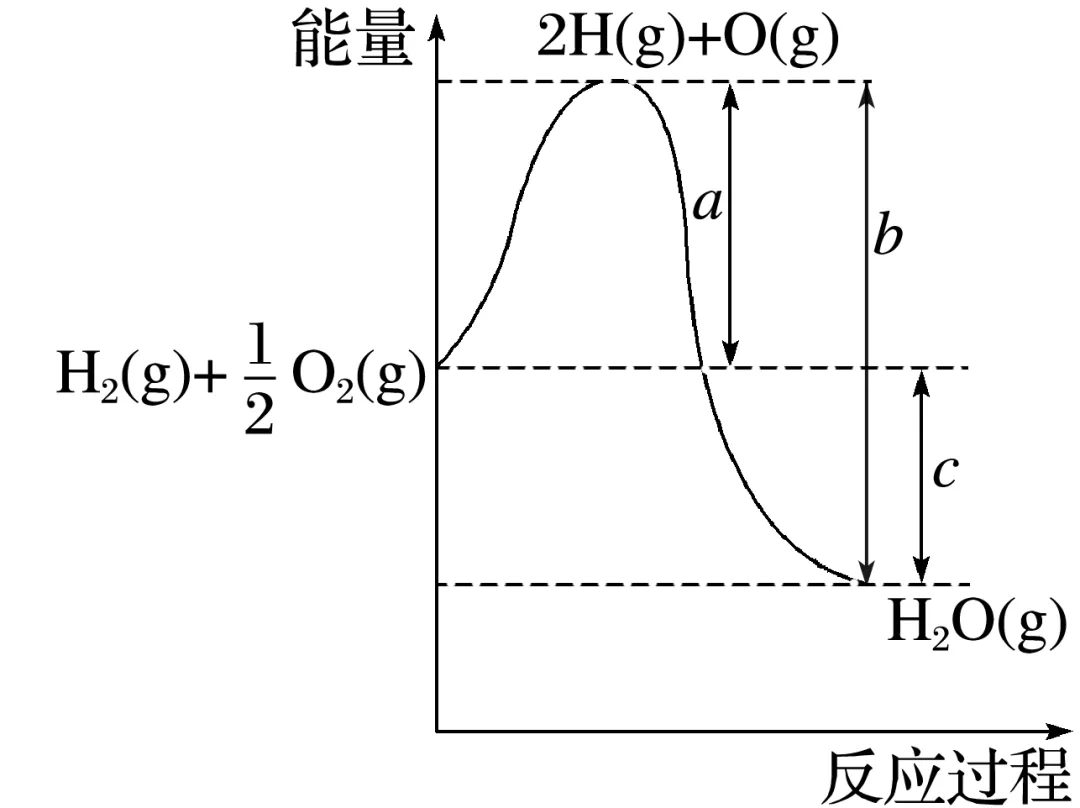
(1)a、b、c分别代表什么意义?
a:________________________________________________________________________;
b:________________________________________________________________________;
c:________________________________________________________________________。
(2)该反应是________(填“放热”或“吸热”)反应,ΔH________(填“>”或“<”)0。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享