重症感染领域是一个普遍缺乏对权威足够尊重的领域。在肿瘤化疗(Chemotherapy)方面,医生通常会承认专业界限并寻求专家意见。然而,在抗感染治疗领域,从内科到外科,从教授到实习医生,几乎无人认为自己不懂抗感染,但事实并非如此。
在抗感染领域存在诸多错误概念或误区。例如,有人认为生物标志物能明确区分感染与非感染;有人认为重症感染等同于多重耐药菌感染;在感染诊断上也存在诸多问题。本次课程将就其中部分误区进行交流。
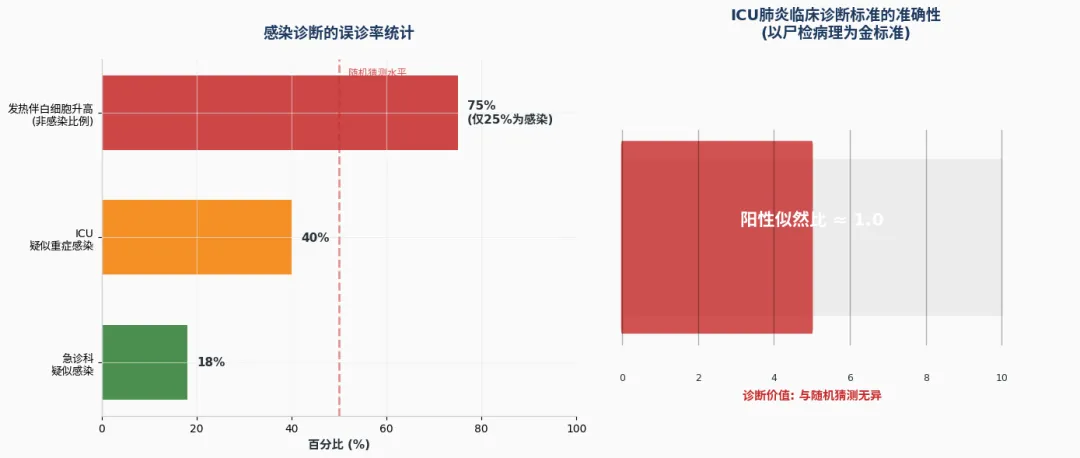
首先,关于感染的定义。一个常见的错误定义是:发热伴白细胞升高,且无法或不愿寻找其他原因时,即诊断为感染。同理,当怀疑感染却无法或不愿定位感染灶时,便诊断为肺炎。然而,这种概念是完全错误的。发热和白细胞升高是炎症反应,而炎症不等于感染。虽然许多炎症由感染引起,但更多炎症由非感染因素引起。
早在25年前的研究就表明,在医院环境中出现的发热伴白细胞升高,仅有约1/4由感染引起,其余3/4需寻找其他原因。后续研究进一步证实:在急诊科疑似感染的病人中,约18%最终被确认无感染;在ICU中,这个比例超过40%。甚至有研究表明,依据现有诊断策略,感染诊断的准确率仅约50%,与抛硬币无异。
以肺炎诊断为例,临床常用的四条标准(发热、白细胞升高、脓性呼吸道分泌物、新出现或加重的肺部浸润影)的准确性如何?以尸检病理为金标准的研究发现,对于ICU内(主要是医院获得性)肺炎的诊断,其阳性似然比仅为1左右。这意味着这些表现在肺炎患者与非肺炎患者中出现的概率相近,依据此临床标准诊断的肺炎很可能并非肺炎。
其次,关于化验结果的解读。我们常陷入一种模式:当化验结果与临床判断不一致时,我们视而不见;只有当化验结果支持临床印象时,我们才将其作为依据。生物标志物的应用便是如此。
我们期望有一个完美的生物标志物(Biomarker)来区分感染与非感染。历史上经过验证的标志物众多,但临床上广泛应用的仍主要是降钙素原(PCT)和C反应蛋白(CRP)。
PCT之所以备受关注,是因为早期研究显示其在区分感染与非感染方面具有较好的判断力,且准确性优于CRP。因此,许多医生依赖PCT诊断感染。但这正确吗?
我们应用PCT的目的并非在已知感染的患者中观察其水平高低。临床真正的问题是:当一位患者PCT结果为2.1 ng/mL时,他究竟是感染还是非感染?早期临床研究表明,PCT在鉴别诊断中存在不少假阳性和假阴性。
那么,当患者PCT阳性时,其真实感染的概率有多大?这取决于患者的验前概率(即检测前临床评估的感染可能性)。若患者验前概率为10%,即使PCT阳性,其感染的后验概率也仅约30%,即仍有70%的可能不是感染。反之,若患者验前概率高达90%,即使PCT阴性,其感染的后验概率仍超过70%。
由此可见,PCT的结果不能脱离临床判断。在某些情况下,临床判断比PCT结果更为重要。因此有言:生物标志物可以使好医生更好,但也可能使坏医生更坏。我们需要反思,在高度依赖PCT时,我们属于哪一种。
第三个误区是将重症感染与耐药菌感染划等号。将感染严重程度与细菌耐药性直接关联是完全错误的概念。
例如,约20年前美国研究比较了社区获得性MRSA(CA-MRSA)与医院获得性MRSA(HA-MRSA)。虽然CA-MRSA对更多药物敏感,但超过3/4的CA-MRSA菌株可产生杀白细胞毒素(PVL),而HA-MRSA仅约5%产毒,两者差异显著。这表明相对敏感的CA-MRSA其实毒力更强。
另一个例子是2005年四川的人感染猪链球菌疫情,其最严重的表现为中毒性休克综合征,病死率超过60%。然而,该猪链球菌对青霉素的耐药率为0。这再次证明,高度敏感的细菌也能引起致命性重症感染。
社区获得性高毒力肺炎克雷伯菌感染(如肺炎伴肝脓肿、菌血症、脑脓肿等)病死率很高,但其菌株通常对二代、三代头孢菌素高度敏感,甚至无需考虑其是否产ESBL,更不必使用碳青霉烯类等高级抗生素。
因此,重症感染仅表示微生物感染导致了严重的器官功能障碍,并不等同于病原体耐药。感染严重程度与病原体毒力有关,而与耐药性无必然联系。
第四个误区是“大包围”式用药思维,即经验性用药必须覆盖革兰阳性菌、阴性菌、厌氧菌和真菌。这种思维定式是错误的。
在社区获得性肺炎中,美国的资料显示成人有26%为病毒性肺炎,儿童则高达73%。刚刚过去的疫情也警示我们,病毒可以引起重症社区获得性肺炎。因此,“大包围”理念并不正确。
对于免疫功能正常的社区获得性肺炎患者,可能的病原体包括细菌、非典型病原体、病毒及其他微生物。试图全覆盖所有可能病原体是不现实且不可能的。感染性脑炎的病原谱更为广泛,经验性治疗无法全部覆盖。
若执意覆盖社区获得性肺炎所有可能病原体,则需要联合使用多种抗生素(如抗细菌、抗非典型病原体、抗病毒、抗真菌药),即便如此仍可能漏诊肺孢子菌、诺卡菌、钩端螺旋体、李斯特菌等。因此,指南中“经验性抗生素需覆盖所有可能病原微生物”的表述是错误的。准确的表述应为“覆盖最可能的病原微生物”,虽仅一两字之差,但本质迥异。
第五个误区是盲目追求“尽早”使用抗生素,例如指南推荐的“1小时内用药”。
这一观念源于类似2006年加拿大的一项研究。该研究显示,在感染导致低血压后,抗生素每延迟1小时使用,患者存活率随之下降,两者相关性显著。因此,许多指南推荐1小时内用药。
但这一结论正确吗?该研究从2731例患者数据库中筛选出2154例进行分析,排除了558例在低血压发生前已用上正确抗生素的患者。若作者结论正确,这558例更早用药的患者存活率应最高。然而数据显示,他们的存活率与后续分析中的患者并无优势。因此,“越早越好”的结论值得商榷。
美国另一项研究显示,当将社区获得性肺炎的抗生素使用时间标准从8小时内缩短至4小时内,实际用药时间并无变化(均约3小时),但被诊断为肺炎的患者中,真正符合肺炎诊断的比例却从46%显著下降至34%。这意味着,为满足时间要求,医生可能降低诊断标准,导致抗生素滥用。
盲目追求提早用药,而不留给医生充足时间进行病史询问、体格检查、回顾资料以准确判断感染是否存在、定位感染灶、推断最可能病原体,继而精准指导用药,这本身存在风险。
总结而言,感染的诊断并不容易。准确判断病原微生物是正确使用抗生素的前提。在此过程中,广谱抗生素并非永远是正确的答案。