

第2课时 电解原理的应用
[核心素养发展目标] 1.认识电解原理在氯碱工业、电镀及电冶金等工业生产中的实际应用。2.深化对电解原理的理解。
一、电解饱和食盐水——氯碱工业
1.氯碱工业的概念
烧碱、氯气都是重要的化工原料,习惯上把____________________的工业生产叫做氯碱工业。
2.电解饱和食盐水的原理(用惰性电极电解)
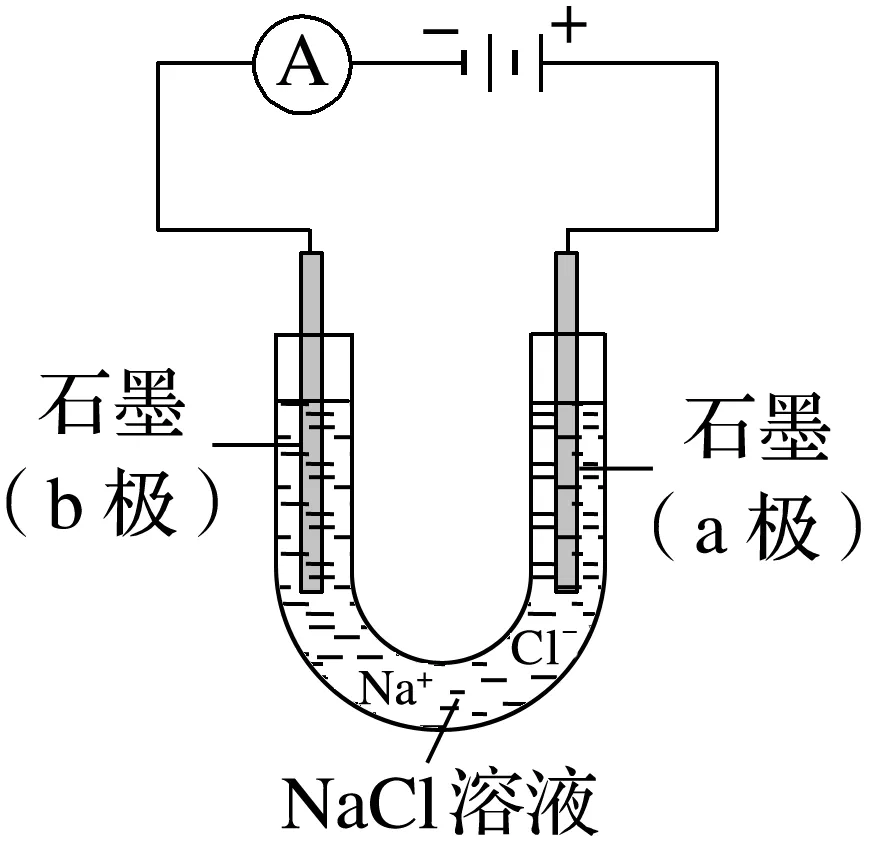
通电前:溶液中的离子有_____________________________________________________。
通电后:①移向阳极的离子是_________________________________________________,在阳极放电的离子是________。
阳极电极反应:_________________________(________反应)。
②移向阴极的离子是________________,在阴极放电的离子是________。
阴极电极反应:________________________ (________反应)。
③总反应:
化学方程式:___________________________________________________________________;
离子方程式:___________________________________________________________________。
3.氯碱工业生产流程
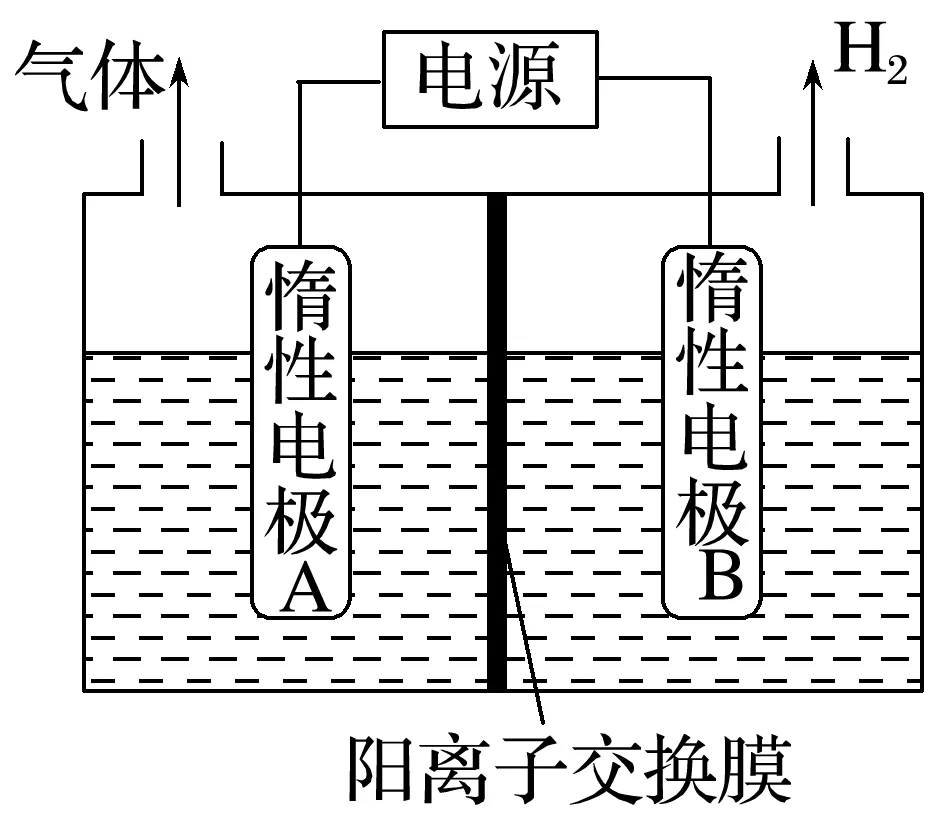
工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行。
(1)阳离子交换膜电解槽
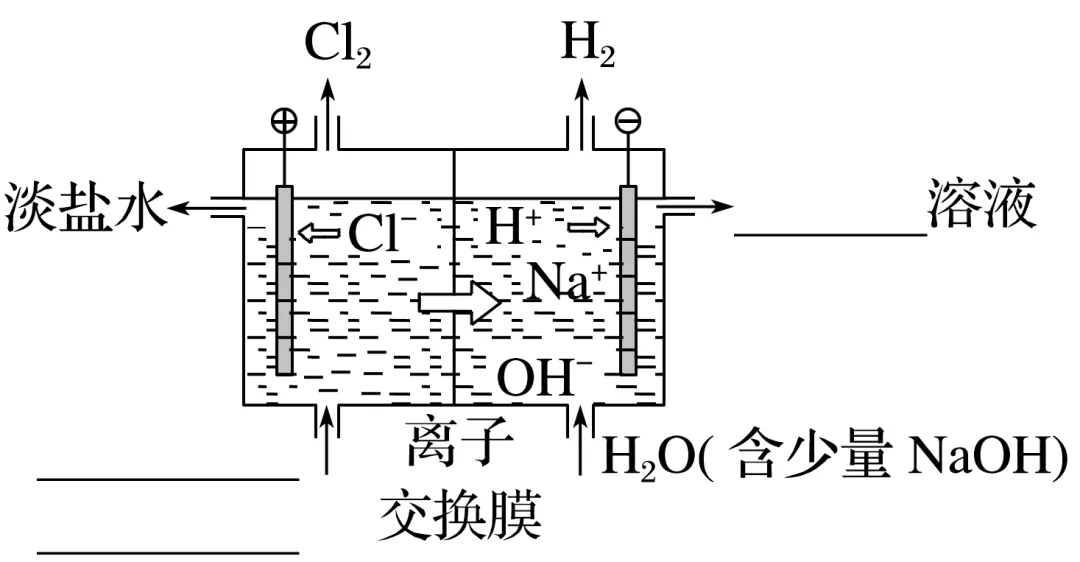
(2)阳离子交换膜的作用:①_____________________________________________________,②阻止________________________________________________________________________。
(3)阴极室一般是加入含少量NaOH的水,目的是________________。
4.氯碱工业产品及其应用
(1)氯碱工业产品主要有________、________、________、________、______________等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用。

(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑( )
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区( )
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)( )
(4)电解饱和NaCl溶液可以制取金属钠( )

1.(2023·浙江6月选考,13)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是( )
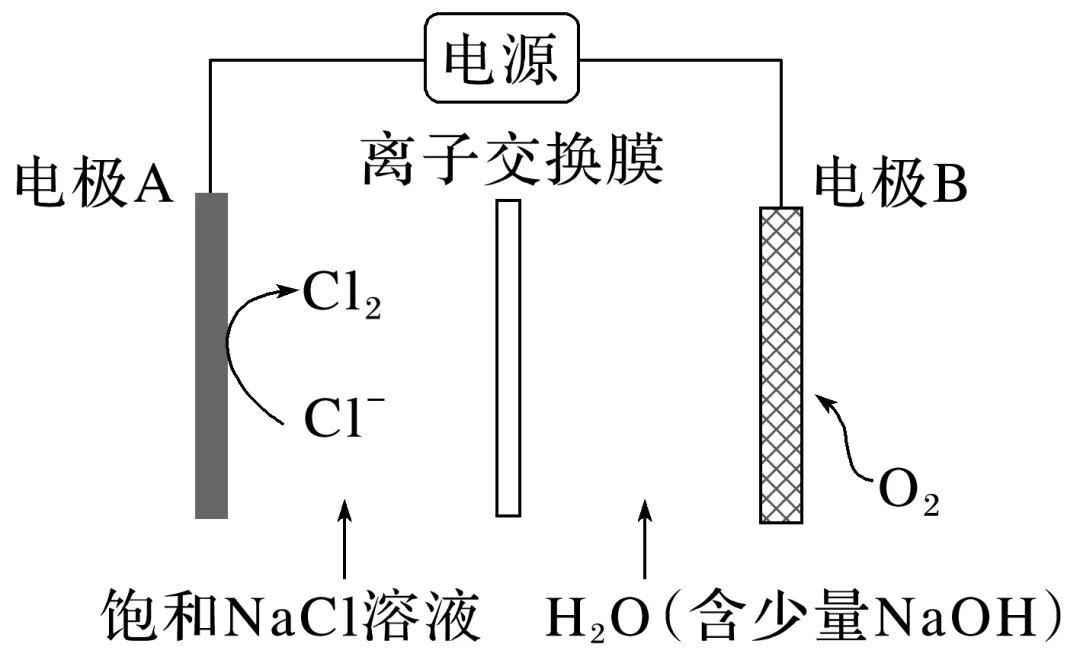
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:2H2O+2e-===H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
2.“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
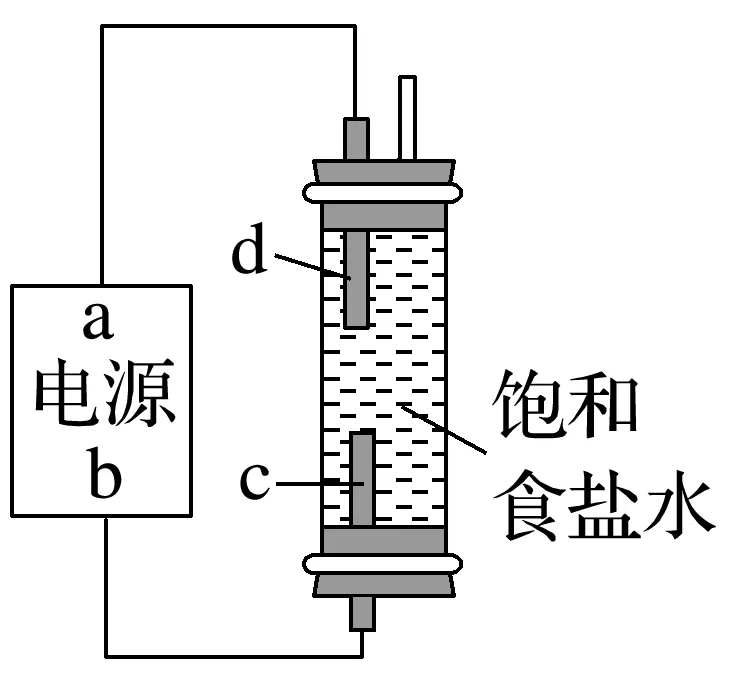
完成下列填空:
(1)a为电源的________(填“正”“负”“阴”或“阳”,下同)极,c为电解池的________极。
(2)d电极的电极反应式:_________________________________________________________,电解产生消毒液的总化学方程式为_________________________________________________。
3. 工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。电极B区电解液为____________(填化学式)溶液,阳极电极反应式为_________________________,电解过程中Li+向电极________(填“A”或“B”)迁移。
二、电镀 电解精炼
1.电镀
(1)电镀:利用________原理在某些金属表面镀上一薄层其他________或________的加工工艺。
(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
(3)电镀池的构成(在铁制钥匙上面镀铜):
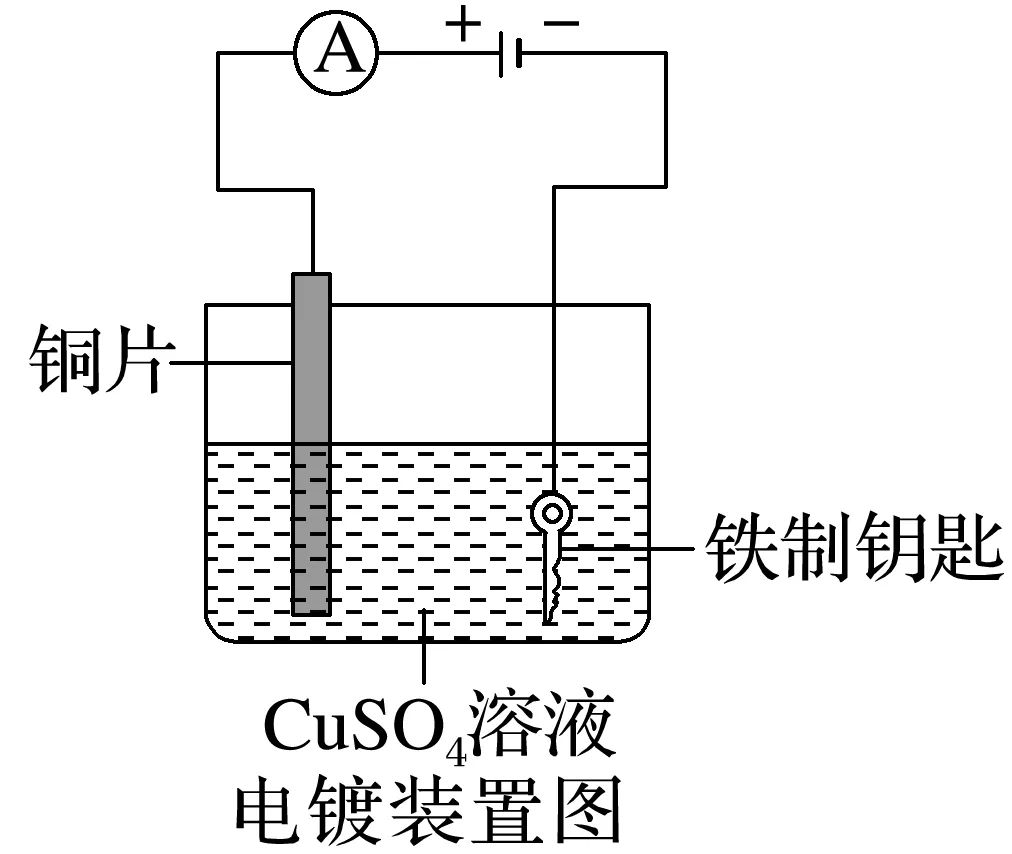
阳极材料:镀层金属________,电极反应:Cu-2e-===Cu2+;
阴极材料:镀件________,电极反应:Cu2++2e-===Cu。
电解质溶液:Cu2+浓度________。
2.电解精炼(粗铜含锌、银、金等杂质)
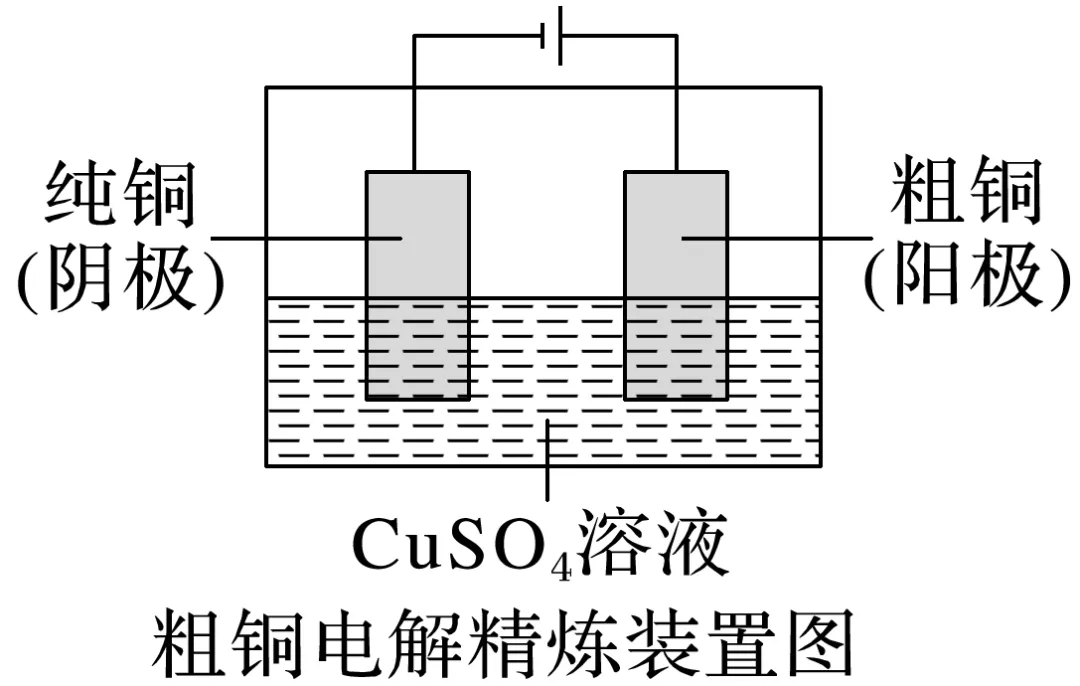
阳极材料:________,电极反应:Zn-2e-===Zn2+、Cu-2e-===Cu2+;
阴极材料:________,电极反应:Cu2++2e-===Cu;
电解质溶液:Cu2+浓度________,金、银等金属沉积形成阳极泥。

(1)在Fe上电镀Zn,应用Zn作阳极,用ZnSO4溶液作电镀液( )
(2)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区( )
(3)电解精炼铜时,电解质溶液的成分不发生变化( )
(4)电镀过程相当于金属的“迁移”,属于物理变化( )

1.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:
(1)阳极发生________反应,其电极反应式:
________________________________________________________________________。
(2)电解过程中,阳极减少的质量与阴极增加的质量________(填“相等”或“不相等”)。
(3)电解后,溶液中存在的金属阳离子有________、________、Ni2+等。
(4)电解后,电解槽底部含有________等金属。
2.利用电解法制备超细银粉的示意图如下,Ag2SO4H2SO4电解液中添加Ti3+/Ti4+,解决了高电流密度下阴极发生析氢反应的问题,并实现Ti3+/Ti4+循环利用。请结合化学用语解释阴极区附近生成超细银粉的原因:___________________________________________________。
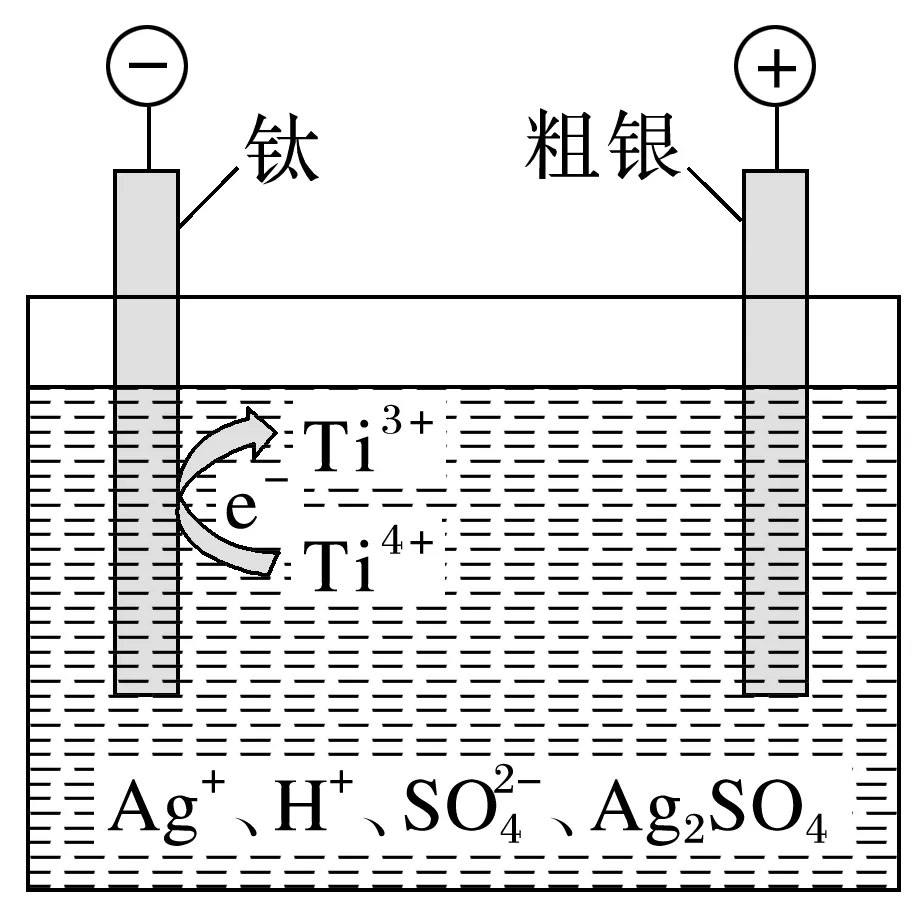
3.[2023·湖南,17(2)]“电解精炼”装置如图所示(以粗Ga为原料制高纯Ga),电解池温度控制在40~45 ℃的原因是_____________________________________________________,阴极的电极反应式为_________________________________________________________________。
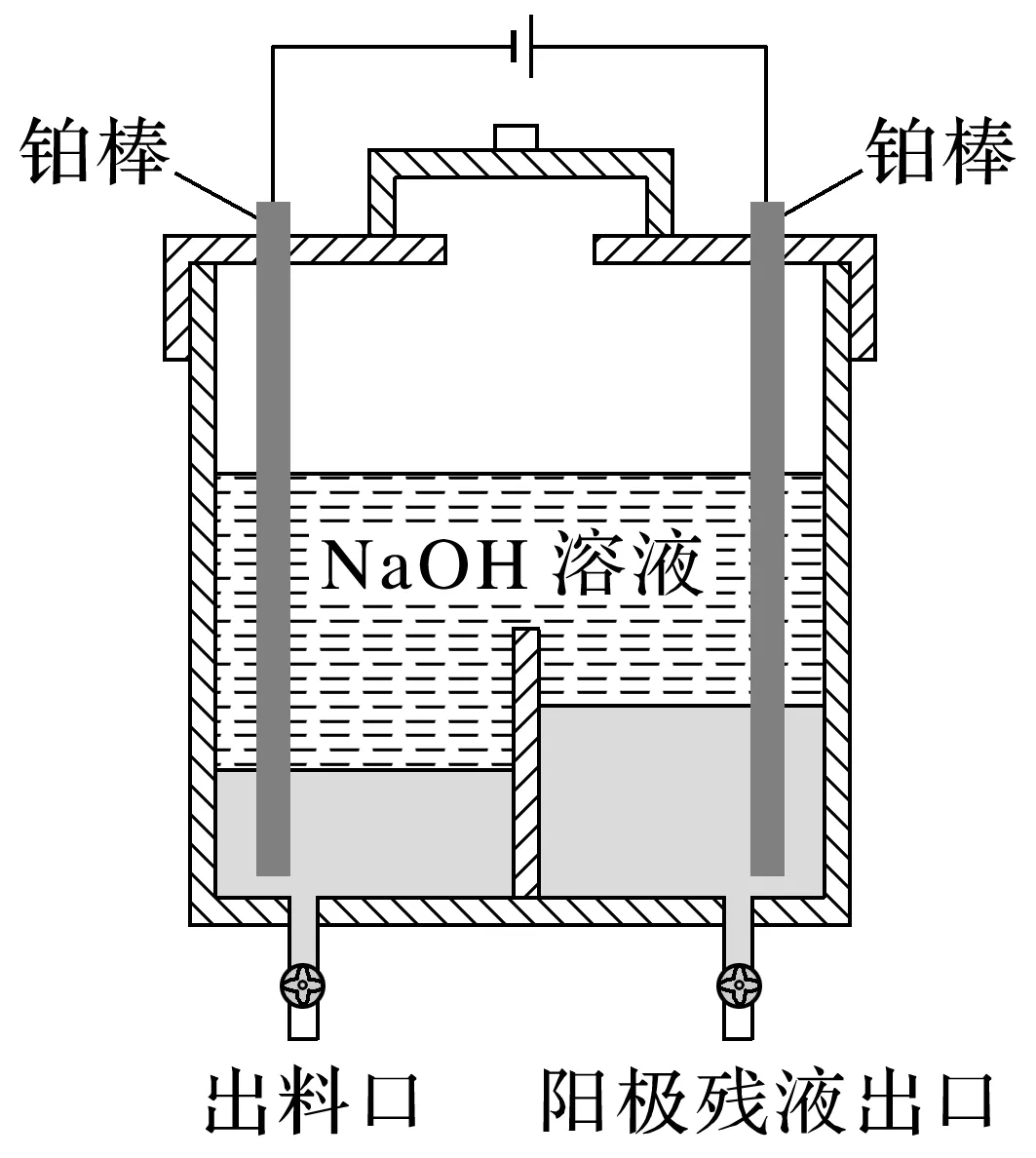
已知:①金属Ga的化学性质和Al相似,Ga的熔点为29.8 ℃。
三、电冶金
1.电冶金的原理
金属冶炼的本质就是使矿石中的________获得电子变成________的过程:Mn++ne-===M。
2.常用电解法制备的金属
电解法用于冶炼较活泼的金属,如________________等。
3.实例分析——冶炼金属钠
(1)电解熔融NaCl装置示意图
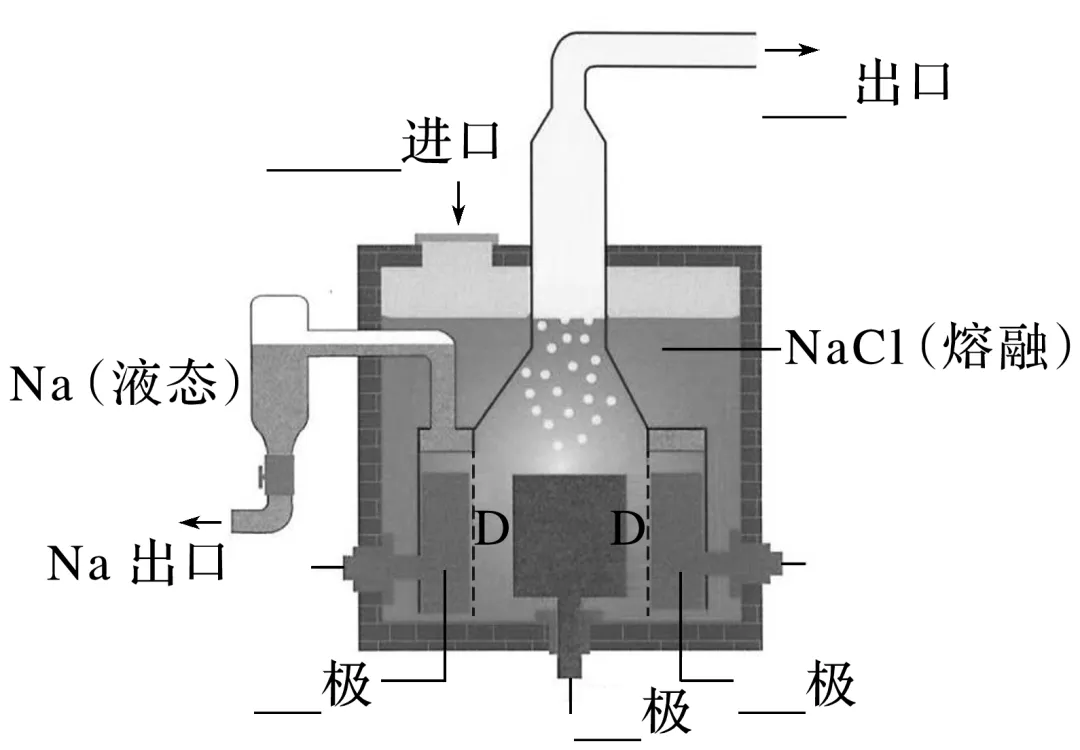
阴极环绕在阳极外面,两极之间用隔膜D隔开。
(2)电解时的反应
阳极:________________________________________________________________________;
阴极:________________________________________________________________________;
总反应:________________________________________________________________________。

(1)活泼的金属往往采用电解法冶炼( )
(2)工业上常用钠与熔融的氯化镁反应制取金属镁( )
(3)工业冶炼金属铝时,电解熔融态AlCl3( )
(4)电解熔融NaOH的化学方程式:4NaOH(熔融)电解,4Na+2O2↑+2H2↑( )
(5)电解碱土金属氧化物和汞的混合物时,汞齐(汞合金)能保护金属( )
(6)冶炼钠和镁的阳极电极反应式均为2Cl--2e-===Cl2↑( )

1.金属镁的工业制备是电解熔融________(填“MgCl2”或“MgO”),原因是____________。
2.如图为工业电解熔融氧化铝冶炼铝的装置示意图。
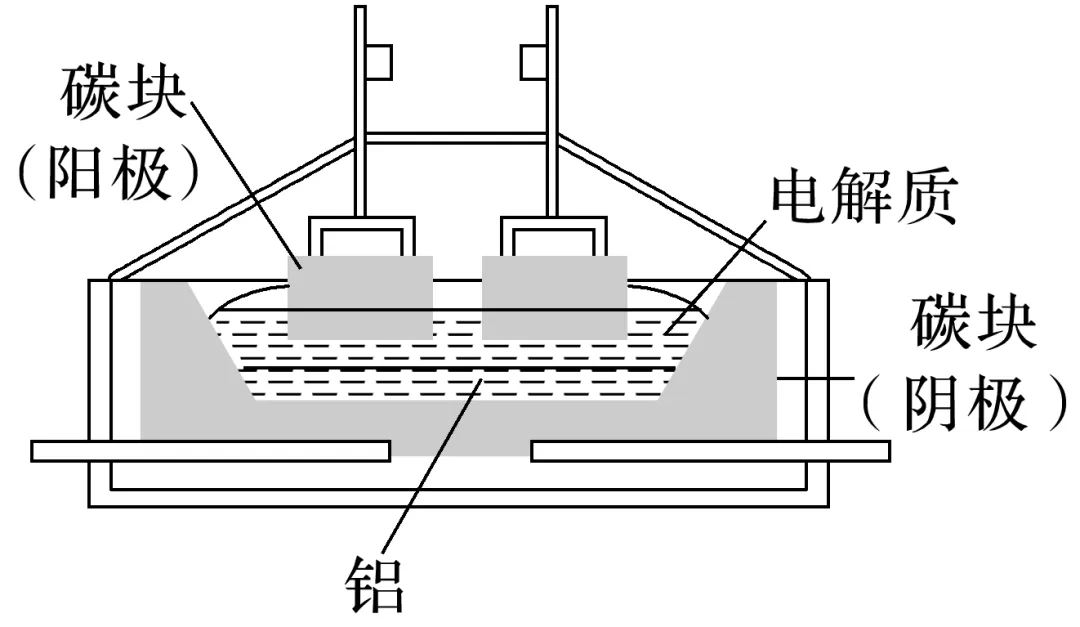
(1)写出电解时的电极反应式及总反应方程式。
__________________________________________________________

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享