

第2课时 电离平衡常数 强酸与弱酸比较
[核心素养发展目标] 1.了解电离平衡常数的含义,能利用电离平衡常数进行相关计算。2.利用电离平衡常数相对大小关系,建立判断弱电解质相对强弱和“强酸制弱酸”的思维模型。
一、电离平衡常数
1.电离平衡常数
概念 | 溶液中弱电解质电离所生成的各种______________,与溶液中____________之比是一个常数,这个常数叫做电离平衡常数,简称电离常数 |
表示方法 | 对于ABA++B-,Ka或Kb=____________________________(酸用Ka,碱用Kb) |
影响因素 | ①同一温度下,不同弱电解质的电离常数取决于________________; ②对于同一弱电解质的稀溶液来说,电离常数只与________有关 |
2.多元弱酸的电离平衡常数
(1)多元弱酸每一步电离都有电离平衡常数,例如H2CO3电离常数表达式(25 ℃时):
①H2CO3H++HCO-3
Ka1=________________=4.5×10-7;
②HCO-3H++CO2-3
Ka2=________________=4.7×10-11。
(2)多元弱酸各步电离常数的大小比较:Ka1>Ka2>Ka3……当Ka1____Ka2时,多元弱酸的酸性主要由___________________________________________________________________决定。

(1)改变条件,电离平衡正向移动,电离平衡常数一定增大( )
(2)同一弱电解质,浓度大的电离平衡常数大( )
(3)H2CO3的电离常数表达式为Ka=2-3cH2CO3( )
(4)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大( )

1.已知25 ℃时Ka(HCOOH)=1.8×10-4,0 ℃时,Ka(HCOOH)________1.8×10-4(填“>”“<”或“=”)。
2.如何从定量的角度判断醋酸溶液中加水稀释一倍后,电离平衡移动的方向?
________________________________________________________________________________
________________________________________________________________________________
3.在某温度时,溶质的物质的量浓度为0.20 mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数Kb。
________________________________________________________________________________
________________________________________________________________________________
4.已知25 ℃时,CH3COOH的Ka=1.75×10-5,计算0.10 mol·L-1的CH3COOH溶液达到电离平衡时c(H+)的浓度。
________________________________________________________________________________
________________________________________________________________________________

有关电离平衡常数的计算模板
HX H+ + X-
起始 c(HX) 0 0
平衡c(HX)-c(H+)c(H+)c(X-)
则K=cH+·cX-cHX-cH+≈c2H+cHX-cH+。
当弱电解质电离程度很小时,c(HX)-c(H+)≈c(HX),则K=c2H+cHX;c(H+)=K·cHX。
二、电离平衡常数的应用
1.电离平衡常数K的意义
K的大小表征了弱电解质的________。
2.电离平衡常数的应用
(1)根据电离常数判断弱酸(碱)的强弱
相同温度下,弱酸的Ka越大,电离程度越____,酸性越____;弱碱的Kb越大,电离程度越____,碱性越____。
(2)根据强酸制弱酸比较电离常数实验32
操作 | 向盛有2 mL 1 mol·L-1醋酸的试管中滴加1 mol·L-1 Na2CO3溶液 |
现象 | |
原理 | 离子方程式为____________________________________________________ |
结论 | Ka(CH3COOH)____Ka1(H2CO3)(填“>”“<”或“=”) |
1.已知:25 ℃时,下列四种弱酸的电离常数:
| CH3COOH | HCOOH | HClO | H2CO3 |
电离 | | | | Ka1=4.5×10-7 |
常数 | 1.75×10-5 | 1.8×10-4 | 4.0×10-8 | Ka2=4.7×10-11 |
(1)试比较相同浓度的CH3COOH、HCOOH、HClO、H2CO3溶液的酸性强弱。
______________________________________________________________________________
______________________________________________________________________________
(2)向CH3COOH溶液中加入一定量的盐酸时,CH3COOH的电离平衡向哪个方向移动?__________________。CH3COOH的电离常数________(填“变大”“变小”或“不变”),理由是________________________________________________________________________。
(3)由表格中的数据判断下列离子方程式不正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO2-3
b.HCOOH+CO2-3===HCOO-+HCO-3
c.HCOOH+CH3COO-===HCOO-+CH3COOH
d.Cl2+H2O+2CO2-3===2HCO-3+Cl-+ClO-
(4)写出向NaClO和CH3COONa的混合溶液中通入少量CO2的离子方程式:________________________________________________________________________
________________________________________________________________________。
2.已知下面三个数据6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2、NaCN+HF===HCN+NaF、NaNO2+HF===HNO2+NaF。
(1)三种酸的强弱顺序是________________________________________________________。
(2)HF的电离常数Ka(HF)=____________________________________________________。
(3)HCN的电离常数Ka(HCN)=_________________________________________________。
3.在一定温度下,加水逐渐稀释1 mol·L-1氨水的过程中,随着水量的增加,请说明溶液中下列含量的变化:
(1)n(OH-)________(填“增大”“减小”或“不变”,下同)。
(2)cOH-cNH3·H2O______。
(3)cNH3·H2O+4________。
三、强酸与弱酸的比较
1.实验探究强酸、弱酸与活泼金属反应的特点
向两个锥形瓶中各加入0.05 g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示:
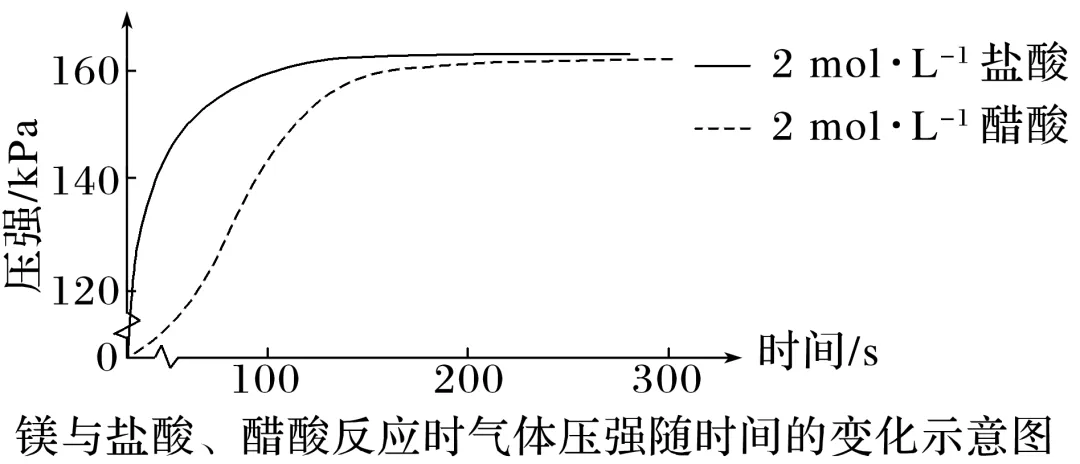
由上述图像分析两种反应的反应速率的变化情况
| 宏观辨识 | 微观探析 |
反应初期 | 盐酸的反应速率比醋酸____ | 盐酸是强酸,______电离,醋酸是弱酸,______电离,同浓度的盐酸和醋酸,盐酸中的c(H+)______,因而反应速率______ |
反应过程中 | 盐酸的反应速率始终比醋酸____,盐酸的反应速率减小________,醋酸的反应速率减小________ | 醋酸中存在电离平衡,随反应的进行,电离平衡________,消耗的氢离子能及时________,所以一段时间内速率变化不明显 |
最终 | 二者产生氢气的量基本______,速率几乎都变为____ | 镁条稍微过量,两种酸的物质的量______,随醋酸电离,平衡正向移动,醋酸几乎______,最终二者与镁条反应的氢离子的物质的量几乎________,因而产生的H2的量几乎________。 两种酸都几乎消耗完全,反应停止,因而反应速率几乎________ |
2.一元强酸和一元弱酸的比较
(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 | c(H+) | 酸性 | 中和碱的能力 | 与足量活泼金属反应产生H2的总量 | 与同一金属反应时的起始反应速率 |
一元强酸 | | | | | |
一元弱酸 | | | |
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 | c(H+) | 酸性 | 中和碱的能力 | 与足量活泼金属反应产生H2的总量 | 与同一金属反应时的起始反应速率 |
一元强酸 | | | | | |
一元弱酸 | | |

1.(2023·宝鸡高二测试)下列关于盐酸与醋酸的稀溶液的说法正确的是( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol·L-1的两溶液稀释100倍,c(H+)均为10-5 mol·L-1
D.向两溶液中分别加入少量对应的钠盐固体,盐酸中c(H+)不变,醋酸中c(H+)增大
2.常温条件下,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12 ; H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。
(1)H+的浓度:H2A________H2B。
(2)酸根离子的浓度:c(A2-)______c(B2-)。
(3)酸分子的浓度:c(H2A)__________c(H2B)。
(4)溶液的导电能力:H2A__________H2B。
3.在a、b两支试管中分别装入形态相同、质量相等的锌粒(锌足量),然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:
相同点是_________________________________________________________________,
不同点是_________________________________________________________________,
原因是___________________________________________________________________。
(2)a、b两支试管中生成气体的体积开始时V(a)__________(填“>”“<”或“=”,下同)V(b),反应完毕后生成气体的总体积V(a)__________V(b),原因是______________
________________________________________________________________________。
(3)若a、b两支试管中分别加入c(H+)相同、体积相同的稀盐酸和稀醋酸,则a、b两支试管中开始生成气体的速率v(a)______(填“>”“<”或“=”,下同)v(b),反应完毕后生成气体的总体积V(a)________V(b),原因是_________________________________________
________________________________________________________________________。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享