

第三节 化学反应的方向
[核心素养发展目标] 1.知道化学反应是有方向的,通过宏观事实推理、建构化学反应的方向与反应的焓变和熵变的关系的认知模型。2.能结合具体事例说明反应自发进行的方向性。
一、自发过程与自发反应
1.自发过程
(1)含义:在一定条件下,不用借助外力就可以自发进行的过程。例如高山流水、自由落体。
(2)特点
①体系趋向于从________状态转变为____________状态(体系对外部做功或释放热量)。
②在密闭条件下,体系有从__________自发转变为____________的倾向(无序体系更加稳定)。
(3)非自发过程:在一定条件下,需持续借助外力才能进行的过程。
2.自发反应
(1)含义:在给定的条件下,无需外界帮助,一经引发即能自动进行的反应,称为自发反应。例如钢铁生锈。
(2)非自发反应:不能自发进行,必须借助某种外力才能进行的反应。
3.应用
(1)自发反应可被用来做“有用功”。例如H2的燃烧可设计成燃料电池。
(2)非自发过程要想发生,必须对它做功。例如通电将水分解为H2和O2。

1.下列过程中属于自发过程的是__________(填序号)。
①铵盐的溶解 ②烧碱与盐酸反应 ③Zn与稀H2SO4反应 ④将地下水抽至地面 ⑤Mg在空气中燃烧 ⑥铝热反应 ⑦墨水在水中的扩散 ⑧电解熔融的氯化钠
2.已知:①2H2+O2点燃2H2O;②2H2O电解2H2↑+O2↑。①是自发反应,②是非自发反应,通过对上述反应的分析,思考:
(1)自发反应不需要任何条件就能发生吗?
________________________________________________________________________________________________________________________________________________________________
(2)非自发反应一定不能发生吗?
________________________________________________________________________________________________________________________________________________________________
二、化学反应进行方向的判据
1.焓变与化学反应的方向

分析下列反应进行的方向与ΔH之间的关系。
(1)H2(g)+12O2(g)===H2O(l),燃烧反应是________(填“吸”或“放”,下同)热反应,ΔH________(填“>”或“<”,下同)0,常温下能自发进行。
(2)Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s),该反应是______热反应,ΔH________0,常温下______(填“能”或“不能”,下同)自发进行。
(3)Ba(OH)2·8H2O 和 NH4Cl的反应为________热反应,常温下________自发进行。
(4)2N2O5(g)4NO2(g)+O2(g),该反应是________热反应,ΔH______0,________自发进行。
2.熵变与化学反应的方向
(1)熵、熵变的概念

(2)熵值大小
①体系的熵值:体系的________越大,体系的熵值就________。
②同一种物质的熵值:S(g)____S(l)____S(s),同一条件下,不同物质的熵值不同。
(3)熵变与化学反应进行方向的关系
①自发进行的化学反应大多是熵________的反应,有些熵________的化学反应也能自发进行。不能只根据熵增或熵减来判断化学反应进行的方向。
②与环境既没有物质交换也没有能量交换的孤立体系或绝热体系,自发过程总向着熵增加的方向进行。

(1)反应CaCO3+2HCl===CaCl2+H2O+CO2↑的ΔS____(填“>”“<”或“=”,下同)0,常温下__________(填“能”或“不能”,下同)自发进行。
(2)2KClO3(s)===2KCl(s)+3O2(g)该反应的ΔS____0,常温下________自发进行。
(3)自发反应4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)的ΔS____0。
(4)二氧化碳通入澄清石灰水的反应Ca(OH)2(aq)+CO2(g)===CaCO3(s)+H2O(l)________自发进行。其ΔS____0。
3.自由能与化学反应的方向
(1)自由能变化
符号为________,单位为kJ·mol-1。
(2)自由能变化与焓变、熵变的关系:ΔG=______________。ΔG不仅与焓变和熵变有关,还与________有关。
(3)反应方向与自由能的关系
化学反应总是向着______________的方向进行,直到体系________。
①当ΔG<0时,反应____________;
②当ΔG=0时,反应____________;
③当ΔG>0时,反应____________。
类型 | ΔH | ΔS | ΔG | 反应的自发性 |
1 | <0 | >0 | <0 | 一定能自发 |
2 | >0 | <0 | >0 | 一定不能自发 |
3 | <0 | <0 | 正负决定于温度 | 低温能自发 |
4 | >0 | >0 | 高温能自发 |

(1)在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向( )
(2)自由能变化ΔG<0的化学反应一定能迅速发生( )
(3)SO2(g)===S(g)+O2(g) ΔH>0,ΔS>0,该反应不能自发进行( )
(4)NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向( )

1.(2022·浙江1月选考,20)AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)===An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是( )
A.ΔH和ΔS均大于零
B.ΔH和ΔS均小于零
C.ΔH可能大于零或小于零,ΔS大于零
D.ΔH和ΔS均可能大于零或小于零
2.已知在100 kPa、298.15 K时,石灰石发生分解反应:CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.3 kJ·mol-1 ΔS=+160.4 J·mol-1·K-1,则
(1)该反应________(填“能”或“不能”)正向自发进行。
(2)若温度能决定反应方向,则该反应正向自发进行的最低温度为____________。
3.在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1过程中的能量变化如图所示,回答下列问题。
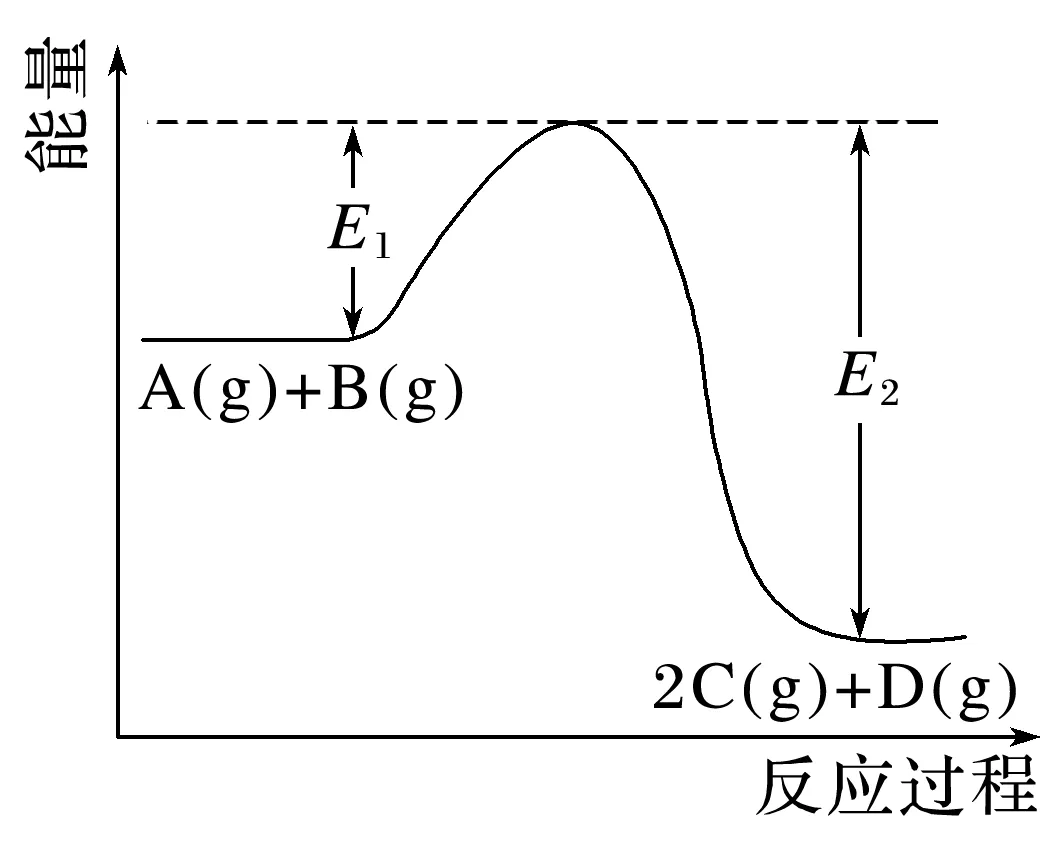
(1)Q________(填“>”“<”或“=”,下同)0。熵变ΔS________0。该反应______(填“能”或“不能”)自发进行。
(2)升高温度平衡常数K________(填“增大”“减小”或“不变”),平衡向__________(填“正反应”或“逆反应”)方向移动。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享