


第一节 化学反应速率
第1课时 化学反应速率
[核心素养发展目标] 1.了解化学反应速率的概念及其表示方法,形成不同的反应可用不同的方法来表示化学反应速率的变化观念。2.根据化学反应速率的测定原理设计实验,学会化学反应速率的测定方法,通过对比的方法,发展基于变量关系的证据推理素养。
一、化学反应速率及其表示方法
1.化学反应速率的概念及其表示方法

2.同一反应中各物质化学反应速率的关系
对于反应mA(g)+nB(g)===pC(g)+qD(g),分别用A、B、C、D表示的化学反应速率的关系为v(A)∶v(B)∶v(C)∶v(D)=________________。

(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)化学方程式中,任何一种物质均可用v=ΔcΔt求出用该物质表示的化学反应速率( )
(3)测定某化学反应从开始到8秒末的反应速率,指的是8秒末的瞬时速率( )
(4)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越大( )

1.某温度下6.5 g锌粒与40 mL 2.5 mol·L-1的硫酸反应,用时10 s时恰好收集H2体积44.8 mL(0 ℃、101 kPa条件下)。
(1)通常可用H+或Zn2+浓度的变化来表示该反应的化学反应速率,若忽略溶液体积的变化,请计算用上述两种物质表示的化学反应速率。
________________________________________________________________________
________________________________________________________________________
(2)为了方便也可以用单位时间内产生H2的物质的量来表示该反应的反应速率,则10 s内该反应的反应速率v(H2)=______ mol·s-1。
2.在反应N2(g)+3H2(g)高温、高压催化剂2NH3(g)中,某段时间内用H2表示的反应速率为0.45 mol·L-1·s-1,则v(NH3)=______mol·L-1·s-1。
二、化学反应速率的计算类型与突破
化学反应速率计算的“三段式”模板
利用转化量之比等于化学计量数之比建立各数据间的关系
如: mA(g)+nB(g)pC(g)
起始/(mol·L-1) abc
转化/(mol·L-1) x nxm pxm
某时刻(t s)/(mol·L-1)a-x b-nxm c+pxm
再利用化学反应速率的定义求算
v(A)=xt mol·L-1·s-1;
v(B)=nxmt mol·L-1·s-1;
v(C)=pxmt mol·L-1·s-1。
类型一 提取表格信息计算化学反应速率
1.在2 L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如下表所示:
| X | Y | Z | Q |
起始/mol | 0.7 | | 1 | |
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | | | 0.8 | |
已知2 min内v(Q)=0.075 mol·L-1·min-1,vZvY=12。
(1)起始时n(Y)=______,n(Q)=________。
(2)化学方程式中m=________,n=______,p=________,q=________。
(3)用Z表示2 min内的反应速率为_____________。
(4)2 min末Q的转化率为________。
2.Bodensteins研究反应:H2(g)+I2(g)2HI(g) ΔH<0。温度为T时,在容积为1 L的密闭容器中加入0.5 mol I2和0.5 mol H2进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 100 |
w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
容器中,前20 min内的反应速率v(HI)=_____________。
类型二 从图像中获取计算的数据
3.一定温度下,向容积为2 L的密闭容器中通入两种气体并使其发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
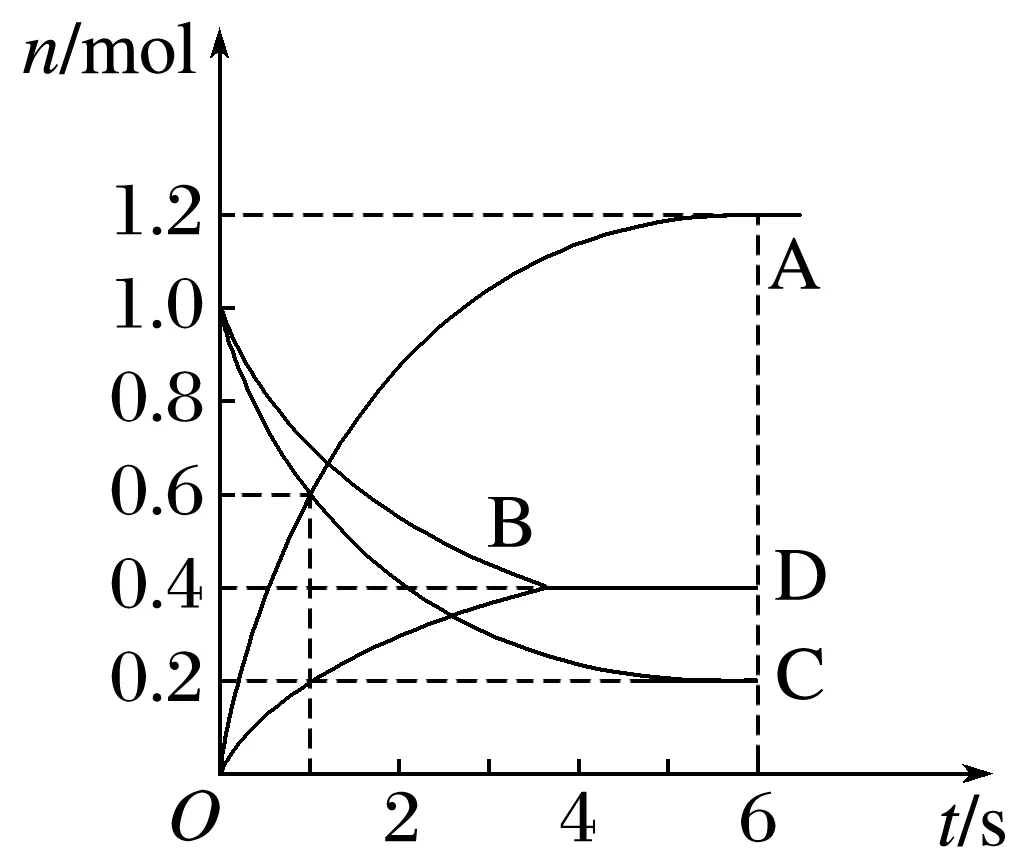
A.该反应的化学方程式为3B+4D6A+2C
B.0~1 s内,v(A)=v(C)
C.0~6 s内,B的平均反应速率为0.05 mol·L-1·s-1
D.0~6 s内,各物质的反应速率相等
4.(2024·上海吴淞中学高二检测)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N===X+Y;②M+N===X+Z。反应体系中组分M、Z的浓度随时间变化情况如图所示。
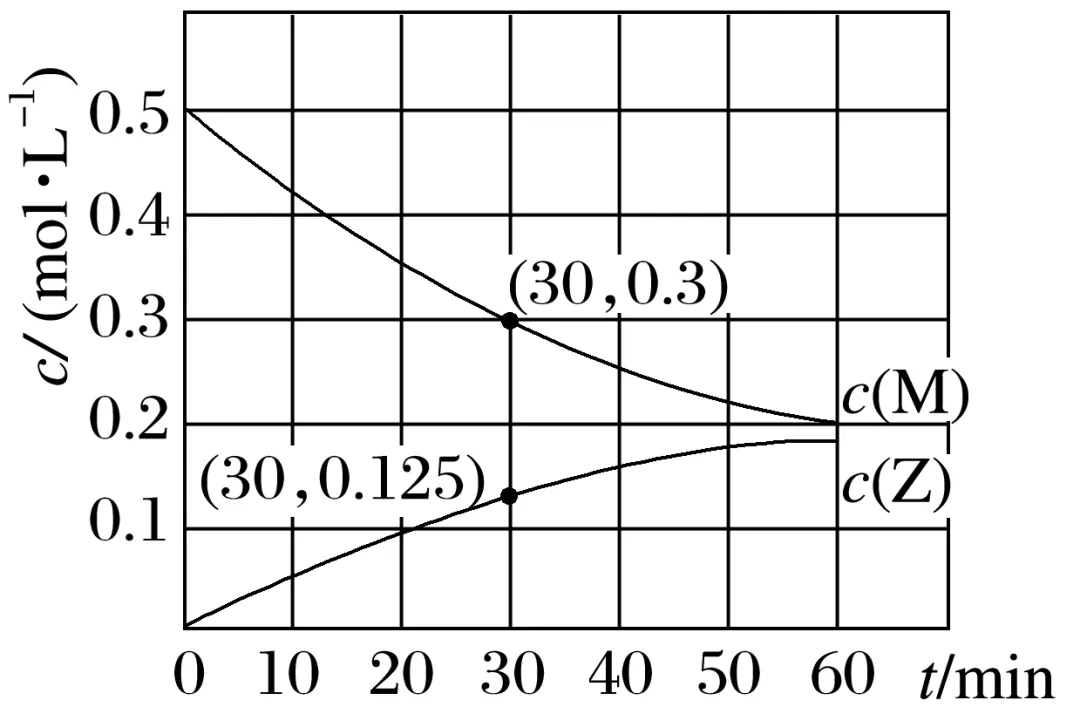
(1)0~30 min时间段内,Y的平均反应速率为__________________。
(2)30 min时,N的转化率为____________。

在用图像计算化学反应速率时,横坐标一般是时间,要特别注意纵坐标是物质的量还是物质的量浓度,甚至其他表示物质量多少的物理量。
类型三 用不同物质表示同一化学反应速率
5.已知3Cl2+2NH3===N2+6HCl。若反应速率分别用v(Cl2)、v(NH3)、v(N2)、v(HCl)表示,则下列关系式正确的是( )
A.32v(Cl2)=v(NH3)
B.13v(Cl2)=v(N2)
C.12v(Cl2)=v(HCl)
D.13v(NH3)=v(HCl)
6.对于反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g),在四种不同情况下测得的反应速率由快到慢的顺序为_________(填序号)。
①v(NH3)=0.2 mol·L-1·s-1
②v(O2)=0.24 mol·L-1·s-1
③v(H2O)=15 mol·L-1·min-1
④v(NO)=9 mol·L-1·min-1

根据数值比较化学反应速率大小的思路
(1)“一看”:看化学反应速率的单位是否一致,若不一致,需转化为同一单位。
(2)“二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应物质的化学计量数。
(3)“三比较”:标准统一后比较数值大小,数值越大,反应速率越大。
三、化学反应速率的测定
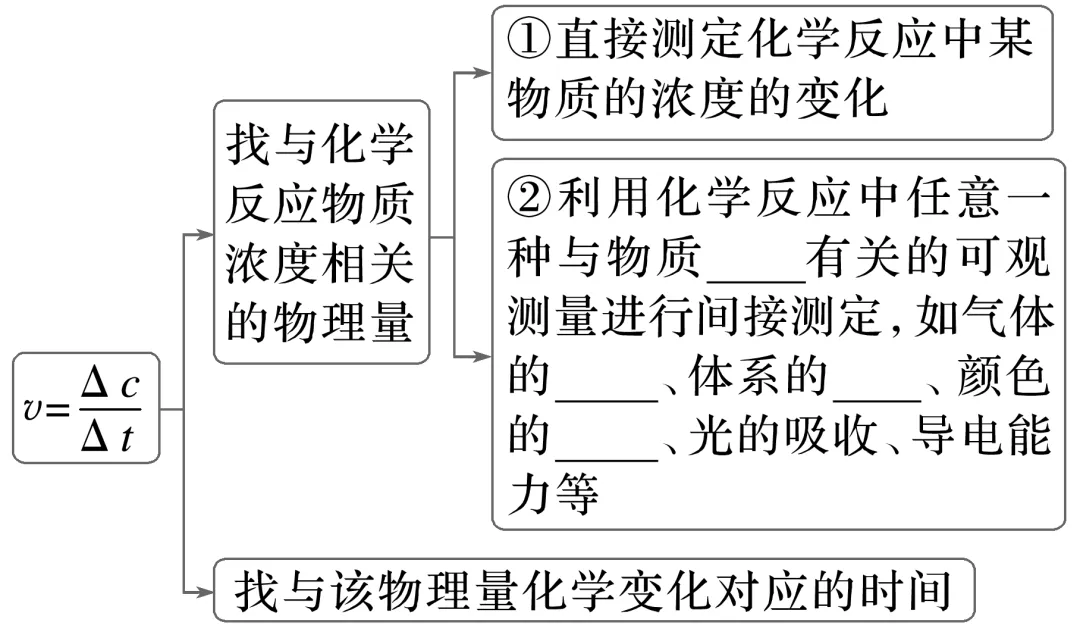
注意 在溶液中进行的反应,当反应物或生成物本身有比较明显的颜色时,可利用颜色变化与浓度变化间的比例关系来跟踪反应的过程和测量反应速率。

1.下列方法能实现对应化学反应速率测定的是____________(填序号)。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享