 n
n
实验活动7 化学反应速率的影响因素
实验目的
1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
实验原理
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O。
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
实验用品
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 mol·L-1 Na2S2O3溶液、0.1 mol·L-1 H2SO4溶液、10% H2O2溶液、1 mol·L-1 FeCl3溶液、MnO2粉末、蒸馏水。
方法指导
为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“十”字,衬在反应容器(锥形瓶)的底部。实验以Na2S2O3和H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“十”字完全遮盖时结束(如图)。通过比较记录反应所需时间,可以判断反应速率的大小。
实验步骤
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol·L-1 Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 | 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL | 加入水的体积/mL | 加入0.1 mol·L-1 H2SO4溶液的体积/mL | 出现浑浊的快慢 | 结论 |
1 | 2 | 0 | 2 | 较快 | 其他条件不变时,反应物浓度越大,反应速率越快 |
2 | 1 | 1 | 2 | 较慢 |
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验 编号 | 加入0.1 mol·L-1 Na2S2O3溶液的体积/mL | 加入0.1 mol·L-1H2SO4溶液的体积/mL | 水浴温度/℃ | 出现浑浊的快慢 | 结论 |
1 | 2 | 2 | 0 | 较慢 | 其他条件不变时,温度越高,反应速率越快 |
2 | 2 | 2 | 40 | 较快 |
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 mol·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
实验 编号 | 加入10%H2O2溶液的体积/mL | 加入的催化剂 | 气泡出现的快慢 | 结论 |
1 | 2 | 无 | 较慢 | 其他条件不变时,加入催化剂,反应速率加快 |
2 | 2 | 少量MnO2粉末 | 很快 |
3 | 2 | 2滴1 mol·L-1 FeCl3溶液 | 较快 |
问题讨论
1.写出硫代硫酸钠溶液与稀硫酸反应的离子方程式,可以从哪些方面来测定硫代硫酸钠与酸反应速率的大小?
提示 S2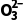 +2H+===SO2↑+S↓+H2O;溶液浑浊出现的快慢或溶液中氢离子浓度的变化(pH的变化)快慢。
+2H+===SO2↑+S↓+H2O;溶液浑浊出现的快慢或溶液中氢离子浓度的变化(pH的变化)快慢。
2.浓度对化学反应速率的影响实验中,实验2加入1 mL水的原因是什么?
提示为了使混合后溶液总体积相同,从而使混合后只有硫代硫酸钠溶液浓度不同,其余因素均相同。
3.在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
提示红热的铁与水蒸气可发生反应生成Fe3O4和H2,是因为反应温度高,反应速率大,且反应物H2O为气态,铁与水蒸气的接触面积大,反应速率大,说明反应条件及反应物状态对化学反应速率有重要影响。
1.结合下表中信息,回答有关问题。
组号 | 反应温度/℃ | 参加反应的物质 |
Na2S2O3 | H2SO4 | H2O |
V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL |
A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| | | | | | |
(1)实验比较法是人们研究各类问题常用的方法,但在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。上表中可以比较的组合有。
(2)上述反应速率最快的是, 最慢的是。
(3)判断上述反应速率快慢的实验现象可以是
。
答案 (1)A和B、B和C (2)D B (3)出现浑浊现象的快慢
解析实验比较法在比较某一因素对实验产生的影响时,必须是在其他条件不变的情况下进行,不难看出A和B、B和C符合。
2.某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25 ℃ | 试管中加入3 mL 5% H2O2溶液 | 1 mL蒸馏水 |
乙 | 25 ℃ | 试管中加入3 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丙 | 40 ℃ | 试管中加入3 mL 5% H2O2溶液 | 1 mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为。
(2)实验甲和实验乙的实验目的是。
实验甲和实验丙的实验目的是。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 |
气体体积/mL | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | 81.5 |
0~20 s的反应速率v1= mL·s-1,100~120 s的反应速率v2=mL·s-1。
不考虑实验测量误差,二者速率存在差异的主要原因是。
答案 (1)2H2O2 2O+O2↑ (2)探究催化剂对反应速率的影响 探究温度对反应速率的影响 (3)0.75 0.6 随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小
2O+O2↑ (2)探究催化剂对反应速率的影响 探究温度对反应速率的影响 (3)0.75 0.6 随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小
解析(2)由表可知实验甲和实验乙除催化剂不同外其他条件都相同,所以实验甲和实验乙是探究催化剂对反应速率的影响;实验甲和实验丙除温度不同外其他条件均相同,则实验甲和实验丙是探究温度对反应速率的影响。
(3)0~20s的反应速率v1=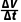 =
=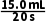 =0.75mL·s-1,100~120s的反应速率v2=
=0.75mL·s-1,100~120s的反应速率v2=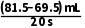 =0.6mL·s-1,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小。
=0.6mL·s-1,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小。

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享