

第2课时 沉淀溶解平衡的应用
[核心素养发展目标] 1.了解沉淀的生成、溶解和转化在工、农业生产中的应用,能运用化学平衡理论分析沉淀的生成、溶解和转化。2.学会从定量的角度分析沉淀的生成与转化的条件。
一、沉淀的生成
1.沉淀生成的应用
应用领域 | 无机物的制备和______、废水______等 |
目的 | 利用________分离物质或除去某些杂质离子 |
2.利用生成沉淀分离或除去某些离子的原则
(1)要使生成沉淀的反应能够发生。
(2)沉淀反应完成后,溶液中剩余离子的浓度能够尽量小。
3.沉淀生成的方法
(1)调节pH法(以除去工业原料氯化铵中杂质氯化铁流程为例)
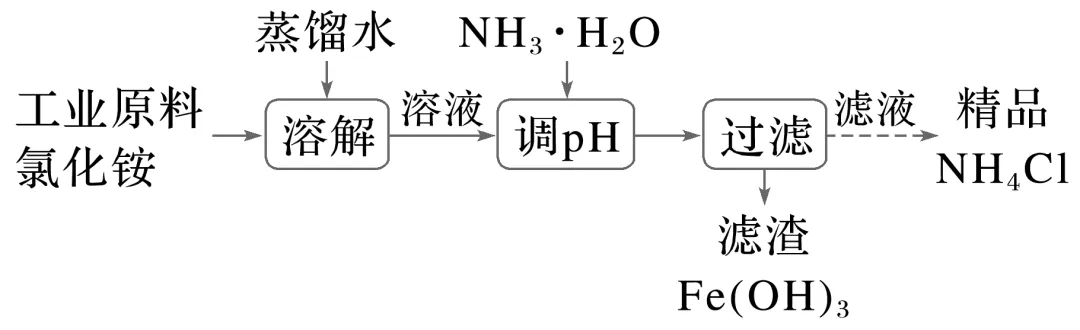
①写出调pH步骤中发生反应的离子方程式:______________________________________。
②调pH除铁时,当溶液中c(Fe3+)=10-5 mol·L-1时可认为Fe3+沉淀完全,计算恰好完全沉淀时溶液的pH=________。为使Fe3+完全沉淀,常采取的措施为________________________________________________________________________
________________________________________________________________________。已知:Ksp[Fe(OH)3]≈1×10-39。
③调pH时能否用NaOH溶液,简述理由:______________________________。
(2)加沉淀剂法(以除去工业废水中的Cu2+、Hg2+为例)
①除杂试剂可选用Na2S、H2S, 原因是__________________________________________。
②分别写出除杂原理的离子方程式。
H2S除去Cu2+:_____________________________________________________________;
Na2S除去Hg2+:____________________________________________________________。
4.化学沉淀法废水处理工艺流程图
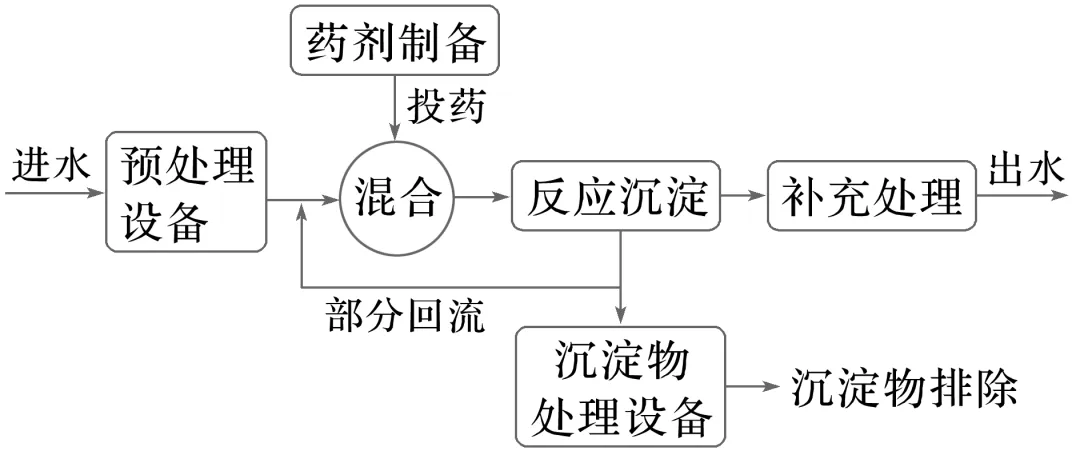

(1)要除去溶液中的SO2-4,选择加入可溶性钙盐比钡盐效果好( )
(2)向MgCl2溶液、AlCl3溶液中分别滴加NaOH溶液至过量,前者生成白色沉淀,后者先生成沉淀,后沉淀溶解( )
(3)除去MgCl2溶液中的Fe2+,可直接加入氨水调pH即可( )
(4)硬水含有较多Ca2+、Mg2+、HCO-3、SO2-4,加热煮沸可以完全除去其中的Ca2+、Mg2+( )

1.已知常温下,CuCO3、Cu(OH)2、CuS的Ksp分别为1.4×10-10、2.2×10-20、6.3×10-36。要除去溶液中的Cu2+,选用下列哪种沉淀剂更好?为什么?
①Na2CO3②NaOH ③Na2S
______________________________________________________________________________
______________________________________________________________________________
2.如果有人误服Ba2+,去医院洗胃时需要用较大量的5%的Na2SO4溶液,已知5%的Na2SO4溶液中SO2-4的物质的量浓度近似为0.35 mol·L-1,BaSO4的Ksp为1.1×10-10,试计算5%的Na2SO4溶液能不能有效的除去胃中的Ba2+。
______________________________________________________________________________
______________________________________________________________________________
3.室温下,下列有关沉淀生成的离子方程式正确的是______________(填序号)。
(1)向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO2-3===Al2(CO3)3↓
(2)向CuSO4溶液中加入过量氨水:Cu2++2NH3·H2O===Cu(OH)2↓+2NH+4
(3)向硫酸铜溶液中加入过量的NaHS溶液除Cu2+:Cu2++2HS-===CuS↓+H2S↑
(4)将K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
(5)Na2S溶液去除废水中的Hg2+:Hg2++S2-===HgS↓
4.(2024·天津高二检测)实验室里制备FeCO3的流程如图所示,下列叙述错误的是( )
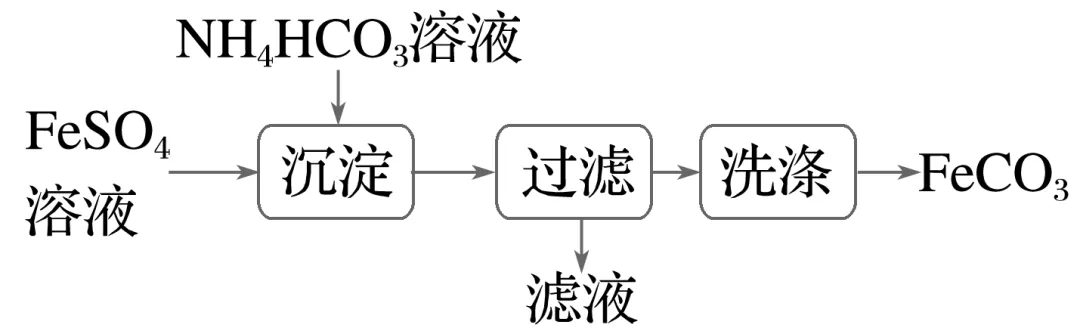
A.过滤需要使用的玻璃仪器有烧杯、漏斗、玻璃棒
B.沉淀过程的离子方程式为Fe2++2HCO-3===FeCO3↓+CO2↑+H2O
C.若沉淀时改用Na2CO3溶液,则产品中可能混有Fe(OH)3
D.将FeCO3在空气中灼烧可以制备FeO
二、沉淀的溶解
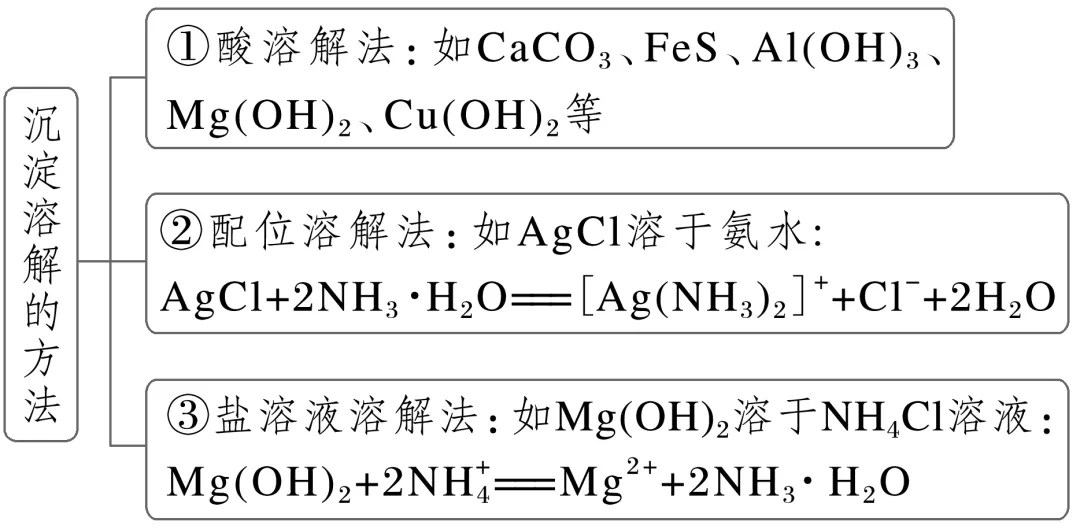
1.沉淀溶解的原理
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的________,使平衡向________的方向移动,就可以使沉淀溶解。
2.应用举例
CaCO3难溶于水,却易溶于盐酸,解释碳酸钙溶于盐酸的原因:_____________________。
3.实验探究Mg(OH)2沉淀的溶解
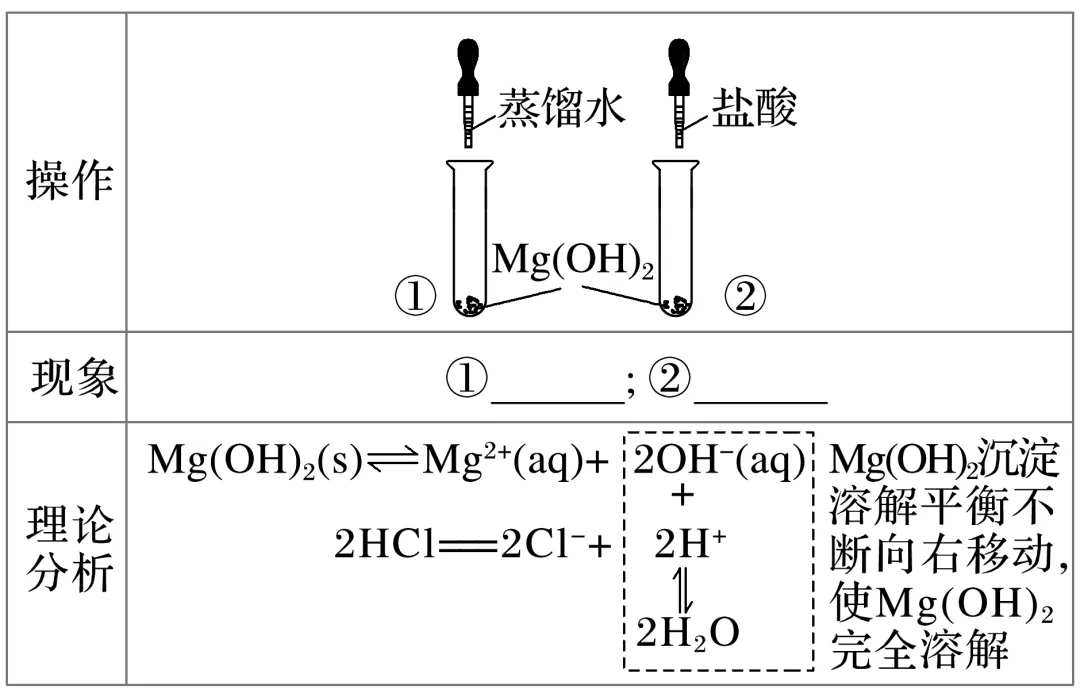
写出Mg(OH)2溶于强酸的离子方程式:___________________________________。

(1)FeS、Al(OH)3、Cu(OH)2均可溶于盐酸( )
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用稀硫酸代替水( )
(3)CaCO3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO3反应( )

1.(1)应用平衡移动原理,解释为什么Mg(OH)2能溶于NH4Cl溶液?
______________________________________________________________________________
______________________________________________________________________________
(2)BaCO3和BaSO4都难溶于水,在医学上常用BaSO4作钡餐透视,而不能用BaCO3的原因是什么?
______________________________________________________________________________
______________________________________________________________________________
2.(2023·湖北黄冈高二期中)从含Cl-和I-的混合溶液中得到AgCl和AgI的流程如图:
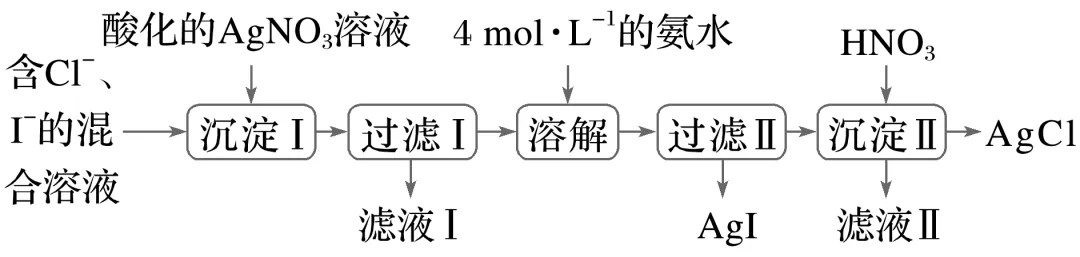
(1)“沉淀 Ⅰ”步骤中发生的反应有__________________、___________________。
(2)AgCl可溶于4 mol·L-1的氨水,原因是生成配离子[Ag(NH3)2]+,写出该反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(3)已知[Ag(NH3)2]+Ag++2NH3,“沉淀Ⅱ”步骤中能否用盐酸代替硝酸,简述理由:________________________________________________________________________
________________________________________________________________________。
3.室温下,将0.1 mol·L-1AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积充分混合,一段时间后过滤,得滤液a和沉淀b。取等量的滤液a于两支试管中,分别滴加相同体积、浓度均为0.1 mol·L-1的Na2S溶液和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清;再取少量的沉淀b,滴加几滴氨水,沉淀逐渐溶解。下列说法正确的是( )
A.0.1 mol·L-1 Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.过滤后所得清液中一定存在:c(Ag+)=KspAgClcCl-且c(Ag+)>KspAg2SO42-4)
C.沉淀b中滴加氨水发生反应的离子方程式:AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
D.从实验现象可以得出该温度下Ksp(Ag2S)>Ksp(Ag2SO4)

三、沉淀的转化
1.沉淀转化的过程探究
(1)实验探究AgCl、AgI、Ag2S的转化
实验操作 | 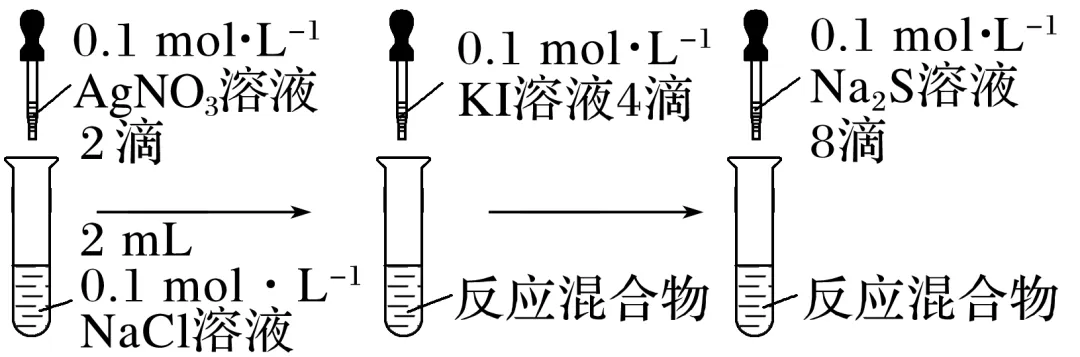
|
实验现象 | 有白色沉淀析出 | 白色沉淀转化为黄色沉淀 | 黄色沉淀转化为黑色沉淀 |
化学方程式 | NaCl+AgNO3=== _______ | AgCl+KI_______ | 2AgI+Na2S ___________ |

①通过上述实验,你能比较出AgCl、AgI、Ag2S三者溶解度的大小及Ksp的大小顺序吗?
______________________________________________________________________________
______________________________________________________________________________
②已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,试应用平衡移动原理解释为什么AgCl能转化成AgI?写出该沉淀转化反应的离子方程式。
______________________________________________________________________________
______________________________________________________________________________
(2)实验探究Mg(OH)2与Fe(OH)3的转化
实验操作 | 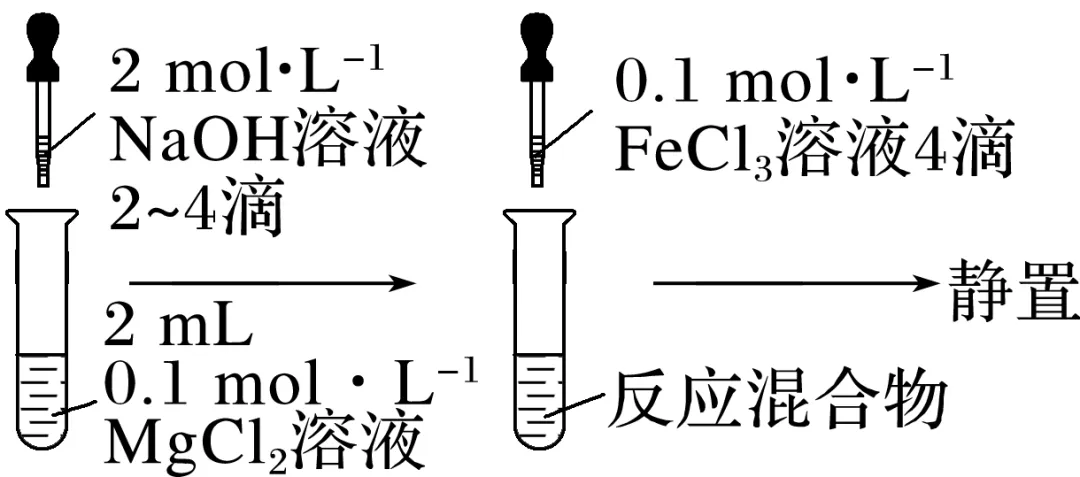
|
实验现象 | 产生白色沉淀 | 白色沉淀转化为红褐色沉淀 |
化学方程式 | MgCl2+2NaOH===__________ | 3Mg(OH)2+2FeCl3__________ |

已知:Ksp[Mg(OH)2]=5.6×10-12,Ksp[Fe(OH)3]=2.8×10-39,试应用平衡移动原理解释为什么Mg(OH)2能转化成Fe(OH)3?
______________________________________________________________________________
______________________________________________________________________________
2.沉淀转化的实质与条件
(1)沉淀的转化是指由一种难溶物转化为另一种难溶物的过程,其实质是_______________。
(2)条件:一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现,两者的溶解度相差________,转化越________。
(3)当两种沉淀的溶解度相差不太大时,也可通过提高转化试剂的浓度实现溶解度小的沉淀转化为溶解度较大的沉淀。

(1)溶解度小的沉淀不能转化为溶解度比其大的沉淀( )
(2)向AgCl沉淀中加入KI溶液,由白色沉淀转变成黄色沉淀,是由于Ksp(AgI)<Ksp(AgCl)( )
(3)可用FeS除去废水中的Hg2+、Ag+等,是因为HgS、Ag2S比FeS更难溶( )
(4)用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3( )

1.某小组研究沉淀之间的转化,实验设计如下(已知:AgCl为白色固体,AgI为黄色固体):
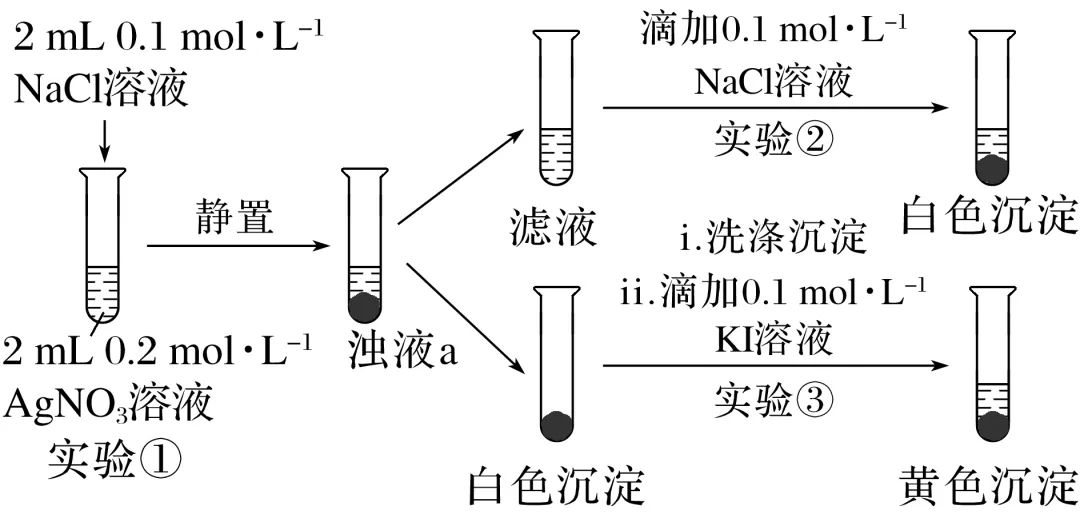
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.实验①和②说明Ag+(aq)与Cl-(aq)的反应是有限度的
C.实验③中颜色变化说明AgCl转化为AgI
D.实验①和③可以证明AgI比AgCl更难溶
2.沉淀转化在工、农业生产中有广泛的应用。
(1)锅炉除水垢(含有CaSO4),常温下CaCO3、CaSO4的Ksp分别为3.4×10-9、4.9×10-5,处理流程如下。

①写出沉淀转化Ⅰ的离子方程式:______________________________________________
___________________________________________________________________________,

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享