结合与融合
HIV-1病毒感染必须首先与靶细胞结合,这一过程由病毒包膜蛋白或病毒颗粒表面的宿主膜蛋白介导,通过与靶细胞表面聚糖或黏附因子之间的半特异性或非特异性相互作用,从而与靶细胞结合。HIV通过上述方式附着于宿主细胞,使Env蛋白能与病毒受体CD4和辅助受体紧密接触,从而提高感染效率。
为了将病毒有效载荷递送至细胞内,由gp120和gp41亚基组成的HIV Env首先附着于宿主细胞,并与受体CD4分子结合。这导致Env发生构象变化,从而允许其与辅助受体结合,该结合部分由Env的V3环介导。随后,gp41的融合肽插入靶细胞膜,启动膜融合过程,最终形成六螺旋束并完成膜融合。
逆转录
病毒与细胞进行膜融合后,包裹RNA与酶的病毒衣壳核心被释放到细胞质中,衣壳在细胞质中穿行,保护其内容物免受先天免疫传感器的攻击,同时衣壳内部的逆转录酶启动逆转录过程,将病毒RNA基因转化为双链DNA。
已知前病毒DNA两端均有LTR序列,每个LTR包含三个元件:U3、R和U5。病毒RNA的转录起始于5′ LTR的U3-R连接处,由于U3作为启动子,它位于起始位点的“上游”,因此5′ LTR中的U3序列不会被转录到RNA中。转录终止于3′ LTR的R-U5连接处,R元件包含poly-A信号,当聚合酶到达R元件末端时,它会添加poly-A尾并停止,留下3′ U5序列。在因此,病毒mRNA缺少5′ U3和3′ U5,从而形成两侧带有R元件的病毒RNA。
在病毒基因组的5′端附近有一个18个核苷酸长的片段,称为引物结合位点(PBS),它与人类tRNALys3的3′端18个核苷酸互补,不同的逆转录病毒使用不同的宿主tRNA作为引物。当细胞 tRNA 与 PBS 杂交时,它作为 RNA 引物,引导逆转录酶的 DNA 聚合酶活性以病毒 RNA 基因组为模板,启动第一链(负链)DNA 合成,复制U5和R区。与此同时,RNA-DNA杂交链中的RNA会被RT的RNase H活性降解,释放-DNA。
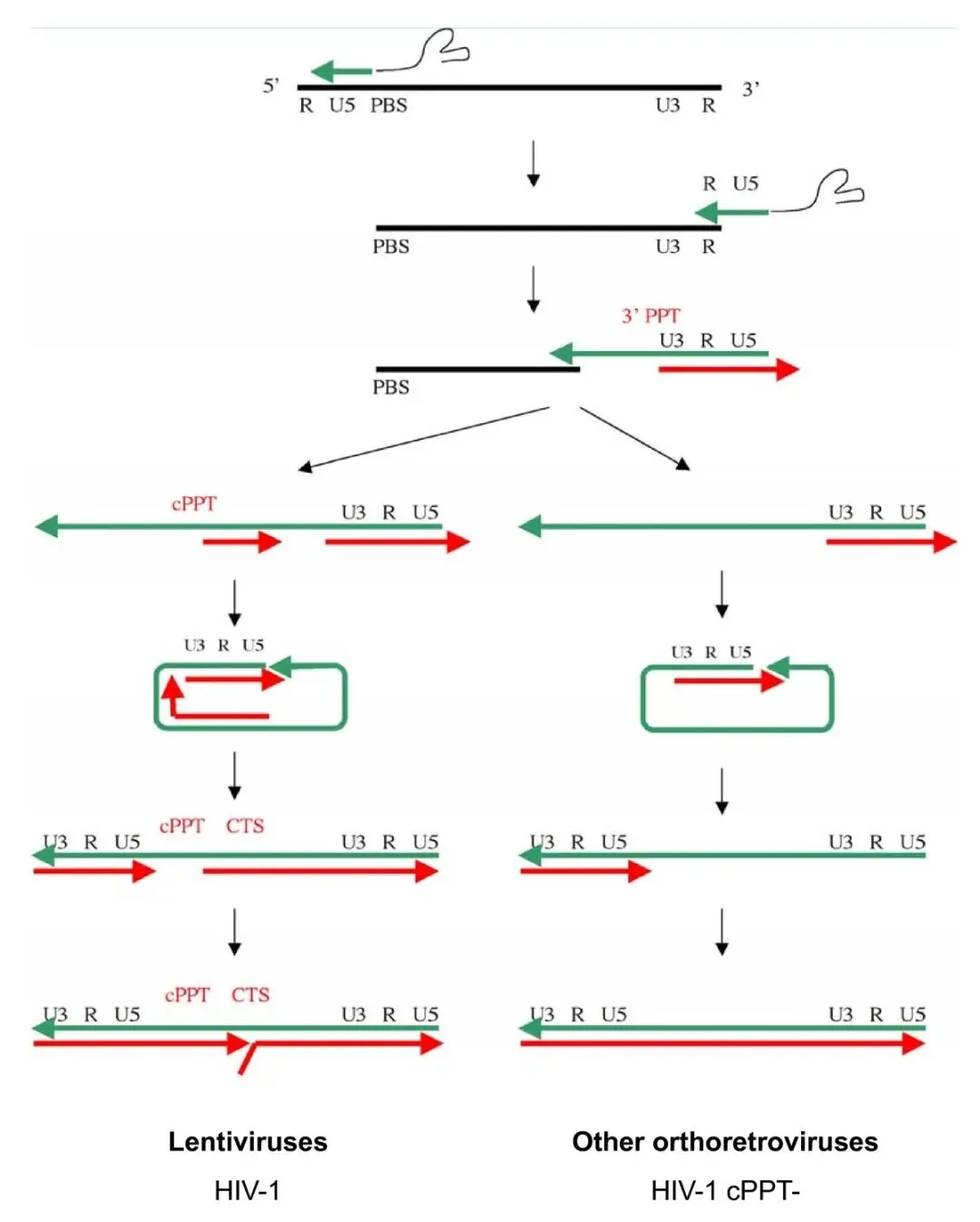
图7. 病毒逆转录示意图
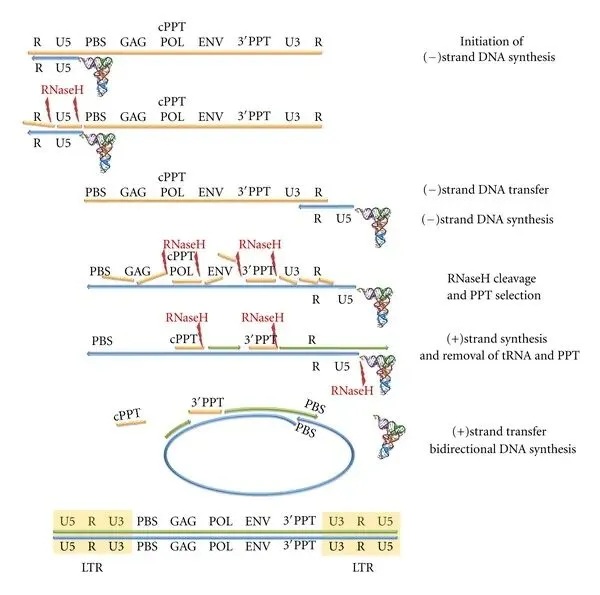
图8. HIV逆转录示意图
-DNA通过与基因组RNA 3' 端的R区互补杂交,从而‘跳跃’至相同或另一RNA的3' 末端,发生链转移,使得负链DNA继续延伸;-DNA合成过程中,RNase H功能在多个位点切割RNA-DNA杂交链中的RNA链,留下2个具有RNase H抗性的富嘌呤序列 (purine-rich sequence) cPPT和 3' PPT;
+DNA的合成以PPTs为引物,直到延伸至tRNA引物的PBS序列,由RNase H切割移除tRNA;之后发生第二次链转移,+DNA与-DNA的PBS序列互补,双链继续延伸从而生成完整的双链HIV基因组DNA。由于+DNA的合成同时开始于3' PPT和cPPT,两条链最终在中间相遇,上游链延伸至cPPT处后继续延伸约100bp,逆转录酶在此处遭遇中心终止序列(central termination sequence, CTS)停止合成,形成一个稳定的三链结构——DNA瓣(DNA flap)。DNA瓣被普遍认为是信号或结构促进剂,帮助HIV前整合复合物(pre-integration complex, PIC)穿过未分裂细胞的核膜,这也是HIV能感染不活跃分裂细胞的原因,cPPT的突变或缺失将使其几乎丧失感染不分裂细胞的能力。
宿主细胞质中,衣壳晶格直接与宿主细胞逆向运输的马达蛋白——动力蛋白(dynein)结合,劫持微管运输机制,将其运送至细胞核。衣壳蛋白可以像核转运受体(NTR)一样,将衣壳核心以NTR非依赖的方式有效穿过核孔复合体(NPC)的选择性通透屏障,将内容物转运至细胞核中。衣壳的崩解过程尚有争议,一般认为从进入细胞至到达核孔是一个逐渐崩解的过程。
整合
HIV病毒的双链DNA在逆转录后,与整合酶(integrase, IN)、病毒基质蛋白(MA)、Vpr以及宿主细胞的多种蛋白(如BAF、HMGA1、Ini1、LEDGF/p75等)形成PIC。PIC通过NPC进入细胞核,将病毒DNA插入宿主细胞基因组中形成前病毒。
HIV的整合酶是一种特殊的DNA重组酶,属于多核苷酸转移酶家族。整合酶包含约288aa,分为三个结构域:N端结构域(1-50 aa, NTD)、催化核心结构域(50-212 aa, CCD)和C端结构域(212-288 aa, CTD)。NTD有时被称为“锌指”,其功能尚不完全清楚,但普遍认为有助于整合酶形成多聚体;催化结构域含有DDE催化三联体氨基酸,它们与二价金属(通常为Mg2+或Mn2-)结合,形成活性催化位点,在HIV-1整合酶中,这些残基是Asp64、Asp116和Glu152;CTD非特异性地结合DNA,与病毒DNA末端内侧的亚末端区域协同作用。
图9. HIV整合酶结构域示意图
By Hopur3 - Own work, CC BY-SA 3.0
整合过程第一步发生在细胞质中,此时HIV RNA已完成逆转录。整合酶在PIC中,水解切割病毒DNA每个3' 末端,去除保守CA二核苷酸区域3'侧的GT二核苷酸,产生一个含有3'-OH基团的活性中间体。
PIC进入宿主细胞的细胞核后,宿主蛋白LEDGF/p75与PIC和宿主DNA结合,LEDGF/p75作为连接蛋白连接PIC和宿主DNA,整合酶利用HIV DNA 3'-OH基团作为亲核剂,同时在宿主DNA中进行不对称切割,并将病毒DNA的3'-OH连接到宿主DNA的5’-磷酸基团上,发生链转移反应。HIV-1中,宿主DNA的不对称切割通常产生5~~~~核苷酸的缺口。
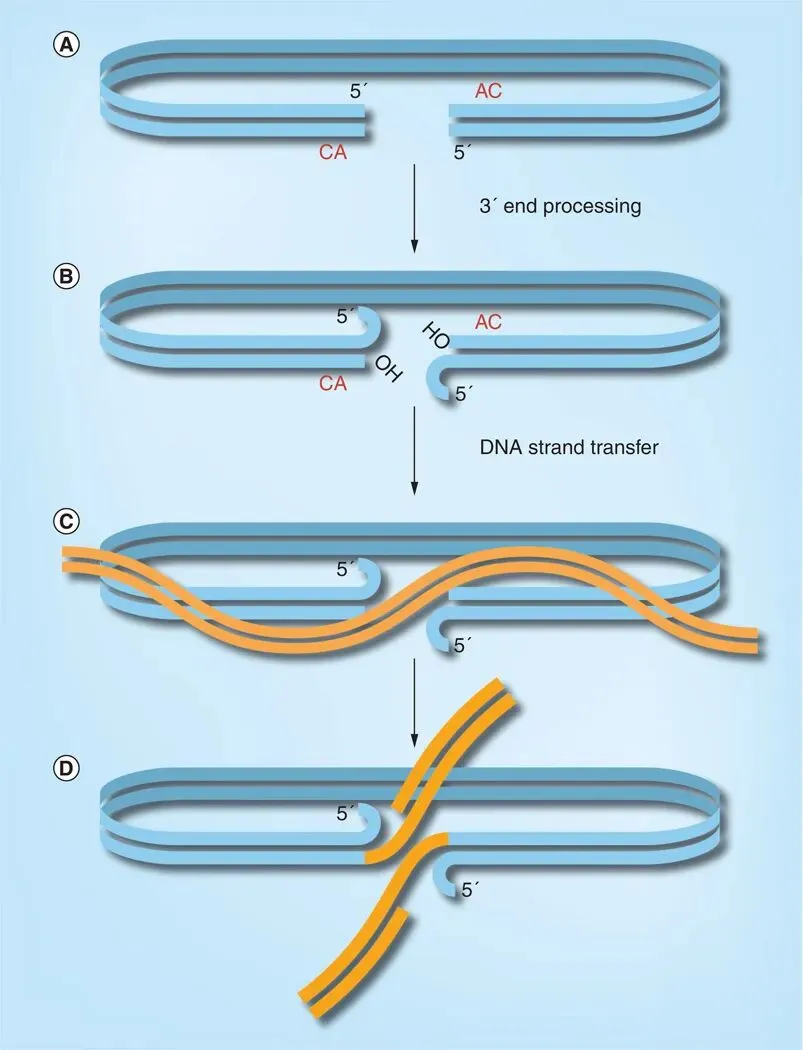
图10. 逆转录病毒整合示意图
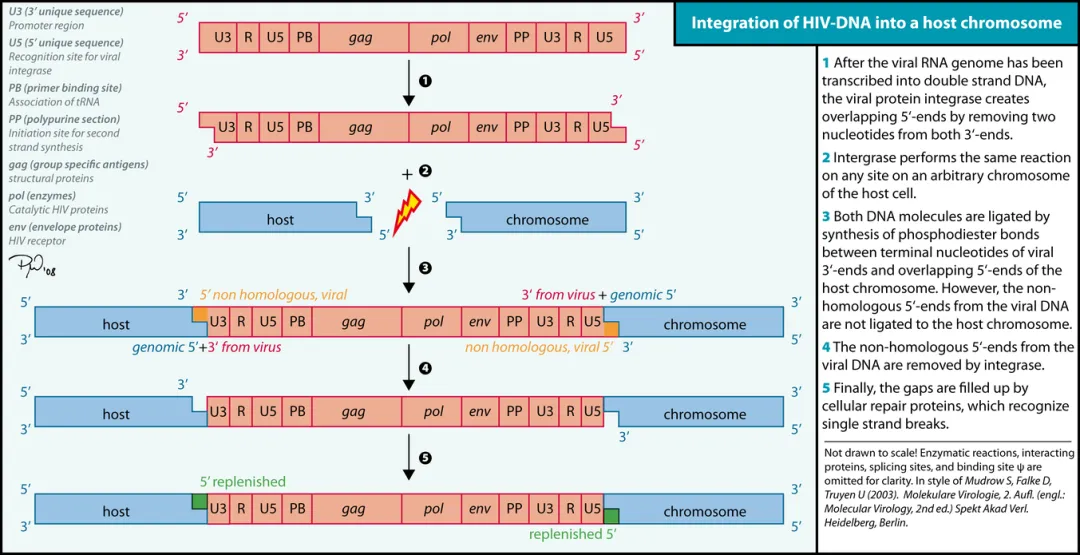
图11. HIV基因组整合
https://en.wikipedia.org/wiki/HIV_integration
宿主细胞的DNA修复机制清除病毒突出的5' 核苷酸,并填补碱基对的制品,导致整合病毒周围宿主DNA序列的重复。
HIV病毒整合到宿主基因组中并非随机,而是倾向于基因密集、转录活跃的基因内部区域。整合位点的选择受多种因素影响,包括染色质结构、核小体的存在以及目标DNA序列。HIV整合酶与宿主细胞的多个因子相互作用,以确定整合位点,如整合酶与LEDGF/p75相互作用,以及病毒CA与CPSF6的相互作用,都会影响整合位点的选择。
转录
整合进入宿主基因组后,HIV-1前病毒由宿主RNA聚合酶II (Pol II) 转录,受5' LTR启动子调控,并由病毒蛋白Tat激活,产生病毒mRNA和基因组RNA。该过程涉及从早期完全剪接的转录本(Tat、Rev、Nef)到晚期未剪接/部分剪接的转录本(Gag、Env)的转变,后者对病毒组装至关重要。
在整合发生后的早期阶段,HIV产生约短的多重剪接mRNA,这些转录本编码关键调控蛋白Tat、Rev与Nef。其中Tat通过结合于病毒基因组5' 端的TAR元件,可显著提高转录效率,它招募P-TEFb等细胞因子,促进RNA转录本的延伸;而Rev可促进未剪接和部分剪接的病毒RNA从细胞核转运至细胞质,这对病毒颗粒的形成至关重要。
图12. HIV启动子结构示意图
随着调控蛋白水平升高,尤其是达到Rev的阈值,转录过程开始向产生更长的未剪接和不完全剪接转录本转变,这些转录本编码结构蛋白和辅助蛋白,如Gag、Pol和Env。
HIV-1转录其基因组利用多个转录起始位点(TSS),包括位于U3-R连接点附近的三个连续鸟苷,生成5′端分别含有3个、2个和1个鸟苷的转录本,分别称为3G、2G和1G RNA。1G RNA优先被选择进行包装,表明这些序列相似度高达99.9%的RNA存在功能差异,凸显了TSS选择的重要性。
组装与出芽
HIV的组装与出芽是一个由病毒Gag多聚蛋白(Pr55Gag)主导的高精度生物过程,主要是宿主细胞的质膜上完成,最终产出未成熟的病毒颗粒。
组装通常始于Gag与病毒基因组RNA在细胞质中的初步相互作用,其NC域中的锌指基序特异性识别5' UTR中的Psi (Ψ) 包装信号,HIV产生的1G异构体会形成暴露Ψ信号的构象,被选择性包装;而3G异构体则倾向于单体状态,主要用于翻译产生蛋白。
图13. HIV Gag结构示意图
Gag蛋白需要被运输到细胞膜的特定区域进行组装,这一过程涉及Gag蛋白的N端肌醇基团和MA结构域中的高碱性区域 (HBR),它们共同介导Gag蛋白与细胞膜的结合。Gag蛋白通过其N端肌醇基团插入宿主细胞膜脂质双层,并与磷脂酰肌醇4,5-二磷酸(PI(4,5)P2)直接相互作用,在结合PI(4,5)P2或发生蛋白多聚化时,Gag蛋白N端的肉豆蔻酰基会从疏水口袋中“翻转”出来并插入脂质双分子层中,从而锚定在细胞膜内侧。Gag倾向于在富含胆固醇和鞘磷脂的脂质筏区组装,这有助于Env糖蛋白的整合。
Gag蛋白的多聚化是病毒组装的关键,主要由CA-CA结构域相互作用驱动,而NC结构域通过与病毒RNA的相互作用,促进Gag蛋白的多聚化。病毒RNA作为支架,帮助Gag蛋白在宿主细胞膜上大量聚合。
Gag蛋白的p6结构域包含晚期域TSG101(ESCRT-1),通过与宿主细胞的内质网分选复合体 (ESCRT) 机制相互作用,促进病毒颗粒的出芽和释放;Gag蛋白在细胞膜上形成未成熟的病毒颗粒,ESCRT复合体负责膜剪切,使病毒颗粒从细胞膜上释放出来。
成熟
HIV病毒出芽后的成熟过程依赖于病毒蛋白酶 (PR) 的激活和对Gag及Gag-Pol多聚蛋白的切割。
图14. HIV Gag蛋白与未成熟、成熟病毒颗粒结构示意图
PR最初以内源性单体形式嵌入GagPol中,必须二聚化才能发挥作用。在病毒组装和出芽过程中,GagPol分子的浓度在受限的空间内升高,促使PR结构域二聚化,通过自催化过程加工自身的N端,去除p6结构域后,形成稳定的PR二聚体,获得完全的酶活性。
成熟的PR能够对Gag和GagPol多聚蛋白在多个位点精确切割,且切割过程遵循特定的动力学顺序,这种时间控制对正确成熟至关重要。首先切割SP1/NC位点,有助于激活Env的融合活性并促进RNP的浓缩;随后切割MA/CA和SP2/p6位点,释放MA蛋白并使其与病毒膜结合;最后切割NC/SP2和CA/SP1位点,特别是CA与SP1的分离是成熟的最后一步,它释放了CA蛋白,使其能够重新组装成成熟的衣壳核心。
多聚蛋白切割后,病毒内部发生剧烈的结构重排。成熟的CA组装成约250个六聚体和12个五聚体单元,形成包裹病毒gRNA的圆锥形“富勒烯”核心;而NC蛋白与病毒gRNA结合,将其凝聚成高密度的核糖核蛋白 (RNP) 复合物,包裹在CA核心中;MA蛋白保持与病毒包膜内侧的结合,形成一层不连续的基质壳。
在成熟阶段,宿主代谢物六磷酸肌醇(IP6)的结合将衣壳的半衰期从几分钟延长到数小时,确保病毒在进入下一宿主细胞后,有足够时间完成逆转录过程。
此外,成熟过程还使病毒上分散且无融合活性的Env三聚体重新分布并形成簇集状态,这种簇集状态和构象变化是病毒与靶细胞结合并进行膜融合的前提。