 n
n
第二节 氮及其化合物
第1课时 氮气和氮氧化物
[核心素养发展目标] 1.通过对氮元素“位—构—性”的分析,认识氮元素在自然界中的存在形式,了解氮的固定的意义。2.掌握N2的性质。3.掌握NO、NO2的性质及二者的相互转化。4.掌握NO、NO2与O2混合溶于水的计算。
一、氮气与氮的固定
1.氮元素
(1)
一般通过共用电子对与其他原子相互结合构成物质。
(2)氮元素在自然界中的存在
2.氮气
思考1 根据氮原子核外电子排布和氮气分子的结构,推测氮气的化学活性。
提示由于氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下难以与其他物质发生化学反应。
在高温、放电等条件下,氮气可以与镁、氢气、氧气等物质发生化合反应。
写出氮气与下列物质发生反应的化学方程式:
①金属镁:N2+3Mg Mg3N2,氮气表现氧化性;
Mg3N2,氮气表现氧化性;
②氢气:N2+3H2 2NH3,氮气表现氧化性;
2NH3,氮气表现氧化性;
③氧气:N2+O2 2NO,氮气表现还原性。
2NO,氮气表现还原性。
思考2 写出镁条在空气中燃烧发生反应的化学方程式。
提示 2Mg+O2 、3Mg+N2
、3Mg+N2 3N2、2Mg+CO2
3N2、2Mg+CO2 。
。
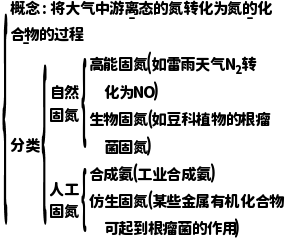
3.氮的固定
1.判断正误
(1)N2和O2在放电的条件下会直接生成NO2( )
(2)氮原子与其他原子只能形成共价键,不能形成离子键( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)工业上将NH3转化为其他铵态化肥属于人工固氮( )
答案 (1)× (2)× (3)√ (4)× (5)×
2.(2024·江苏无锡高一期中)氮气属于地球大气的主要成分,它是地球生命循环——氮循环的重要组成部分,下列关于氮气的说法错误的是( )
A.氮气不燃烧,也无法支持燃烧,不能供给呼吸
B.液氮可用于医学和高科技领域,制造低温环境
C.利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气
D.氮气可用于食品保鲜
答案 A
解析氮气可支持镁的燃烧,故选A。
3.(2024·北京高一期中)下列过程属于自然固氮的是( )
A.用N2和H2合成NH3
B.闪电时大气中氮气和氧气化合生成一氧化氮
C.由氨气制硝酸
D.从空气中分离出液态氮气
答案 B
解析用N2和H2合成NH3,属于人工固氮,A错误;闪电时大气中氮气和氧气化合生成一氧化氮,属于自然固氮,B正确;由氨气制硝酸、从空气中分离出液态氮气不属于固氮,C、D错误。
二、一氧化氮和二氧化氮
1.NO和NO2的物理性质
氧化物 | 颜色 | 状态 | 气味 | 水溶性 |
NO | 无色 | 气体 | - | 不溶 |
NO2 | 红棕色 | 气体 | 有刺激性气味 | 易溶 |
2.NO和NO2的化学性质
(1)实验探究
装置 |
|
操作 | 在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 | ①打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹; ②振荡注射器 |
现象 | 无明显现象 | ①无色气体变为红棕色; ②红棕色气体逐渐变为无色,注射器活塞向左移动 |
(2)实验结论及解释
①NO不溶于水,也不与水反应,但能与空气中的氧气反应生成红棕色的NO2,化学方程式:2NO+O2===2NO2。
②NO2能与水反应生成无色的NO,化学方程式:3NO2+H2O===2HNO3+NO。
思考1 为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置(夹持装置已省略),并检查装置的气密性,实验前用排水法收集NO。
(1)打开止水夹,推动注射器活塞,使O2进入烧瓶。关上止水夹,首先观察到烧瓶中的现象是,写出产生此现象的化学方程式:。
提示气体由无色变为红棕色 2NO+O2===2NO2
(2)轻轻摇动烧瓶,观察到烧瓶中的现象是什么?利用化学方程式解释产生这种现象的原因是什么?
提示烧瓶中的红棕色气体又变为无色,且烧瓶内压强减小,烧杯中的水倒吸进入烧瓶,导致烧瓶中液面上升。摇动烧瓶,使得NO2与水发生反应:3NO2+H2O===2HNO3+NO。
(3)对于反应:3NO2+H2O===2HNO3+NO,用双线桥法标出电子转移的方向和数目:,在反应中若有6molNO2参与反应时,有mol电子发生转移。
提示
3.NO、NO2溶于水的相关计算
思考2 有一只充有20mLNO2和NO混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)。
答案 2∶3
解析设混合气体中二氧化氮的体积为V,则:
3NO2+H2O===2HNO3+NO 气体体积减少
3 1 2
V 20mL-12mL=8mL
所以V=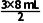 =12mL,即二氧化氮的体积为12mL,则混合气体中一氧化氮的体积为20mL-12mL=8mL,则原混合气体中NO和NO2体积比为8mL∶12mL=2∶3。
=12mL,即二氧化氮的体积为12mL,则混合气体中一氧化氮的体积为20mL-12mL=8mL,则原混合气体中NO和NO2体积比为8mL∶12mL=2∶3。
思考3 假设试管内充有100mLNO,通入多少O2才能使水充满试管?
提示已知:2NO+O2===2NO2①,3NO2+H2O===2HNO3+NO ②,由反应①×3+②×2得:4NO+3O2+2H2O===4HNO3,即当NO和O2的体积比为4∶3时水可以充满试管,故需通入75mLO2。
1.NO2和O2的混合气体与水反应由4NO2+O2+2H2O===4HNO3可知2.NO和O2的混合气体与水反应由4NO+3O2+2H2O===4HNO3可知
1.判断正误
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法( )
(3)NO2与H2O反应生成HNO3,故NO2是酸性氧化物( )
(4)可用湿润的淀粉碘化钾试纸鉴别NO2与溴蒸气( )
答案 (1)√ (2)√ (3)× (4)×
2.(2024·江苏无锡高一期中)下列对NO和NO2的描述正确的是( )
A.NO是无色气体,可用向上排空气法收集
B.NO2与水的反应中,NO2既是氧化剂又是还原剂
C.NO2可由N2和O2直接化合得到
D.从元素化合价角度看,NO只有还原性
答案 B
解析 NO易与O2反应生成NO2,不能用排空气法收集,只能采用排水法收集,A错误;N2和O2在高温或放电条件下反应生成NO,NO2不能直接由N2和O2直接化合得到,C错误;NO中氮元素显+2价,处于中间价态,则NO既有氧化性又有还原性,D错误。
3.现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体2 mL(同温同压下),则原混合气体中氧气的体积可能是。
答案 4 mL或1.2 mL
解析(总反应式法)根据有关的反应:
4NO2+O2+2H2O===4HNO3、3NO2+H2O===2HNO3+NO
设原混合气体中O2的体积为V(O2),剩余气体可能是O2,也可能是NO。
①若剩余O2,则V剩=V(O2)-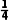 [12mL-V(O2)]=2mL,解得V(O2)=4mL。
[12mL-V(O2)]=2mL,解得V(O2)=4mL。
②若剩余NO,则V剩=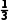 [12mL-V(O2)-4V(O2)]=2mL,解得V(O2)=1.2mL。
[12mL-V(O2)-4V(O2)]=2mL,解得V(O2)=1.2mL。
1.(2024·江苏淮安高一期中)氮及其化合物在生产生活中具有广泛应用。下列关于N2的叙述错误的是( )
A.氮是农作物生长的必需元素
B.N2既可作氧化剂又可作还原剂
C.氮的固定是将N2转化成含氮的化合物
D.1 mol N2可与3 mol H2反应生成2 mol NH3
答案 D
解析 N2与H2反应生成NH3的反应是可逆反应,所以1molN2与3molH2反应生成NH3的物质的量小于2mol,故选D。
2.下列有关氮的氧化物的说法正确的是( )
A.氮的氧化物都能与水反应生成相应的酸
B.NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色
C.NO、NO2都有毒,且NO是汽车尾气的有害成分之一
D.NO是酸性氧化物
答案 C
解析 NO2为红棕色气体,但通入水中后和水反应生成HNO3和NO,溶液无色,B错误;NO、NO2都有毒,且NO是汽车气缸中的氮气和氧气在高温条件下生成的,则汽车尾气中有NO气体,C正确。
3.将装有50 mL NO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3B.3∶5
C.3∶2D.2∶3
答案 C
解析解答此题可根据化学方程式,运用差量法进行计算。设混合气体中NO2的体积为x,
3NO2+H2O===2HNO3+NO ΔV
3mL1mL3mL-1mL=2mL
x(50-30) mL=20mL
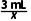 =
=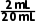 =30mL,则原混合气体中NO的体积为50mL-30mL=20mL,所以V(NO2)∶V(NO)=30mL∶20mL=3∶2。
=30mL,则原混合气体中NO的体积为50mL-30mL=20mL,所以V(NO2)∶V(NO)=30mL∶20mL=3∶2。
4.(2024·天津高一段考)以下是氮循环的一部分:
(1)通常状况下,氮气的颜色是。
(2)反应③的化学方程式是。

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享