细胞单克隆性证明是在临床试验申请和上市申请中的审评要点之一。通常在临床试验通知书上会留这么一条作业,即采用多种方法证明工程细胞和细胞库单克隆性。ICH Q5D指南,中国药典等也有关于细胞库来源于克隆化的细胞的要求。
为什么要关注细胞库的单克隆性?
参考CDE老师发的一篇文献(关于重组药物生产用细胞库单克隆性的审评撕开),宿主细胞和转染后的重组细胞基因组通常不稳定, 在培养过程中其基因型、核型和表型处于不断变化中, 在选择压力存在条件下变化会进一步加剧。因此即使采用来源于单个始祖细胞建立的细胞库在微观上仍然是异质的。单克隆化筛选可以将主细胞库的异质性降低到最小, 以保证产品生产工艺和质量的稳定可控; 同时模拟生产工艺对细胞株的稳定性进行评估能进一步加强工艺控制能力。若细胞库非单克隆来源,当上游工艺发生变化时, 可能会造成细胞亚群或亚克隆的选择性生长, 从而引起生产工艺或最终产品质量属性的改变。来源于一个稳定、可持续供应生产用的单克隆细胞系的细胞库能够更好地保持产品批次之间的质量一致性。
细胞单克隆化常用方法
最经典的为有限稀释法, 近年来基于流式细胞术的单细胞分选 (fluorescence-activated cell sorting, FACS)、克隆筛选单细胞打印系统、ClonePix 高通量细胞克隆筛选系统、新一代测序 (next-generation sequencing, NGS)、细胞成像技术等新技术也逐渐应用于细胞克隆化或者用于确认单克隆性。细胞单克隆性事后证明/质粒整合位点分析方法
FISH (DNA荧光原位杂交,fluorescence in situ hybridization)
Southern Blot
Junction PCR
NGS
一般分选及验证策略
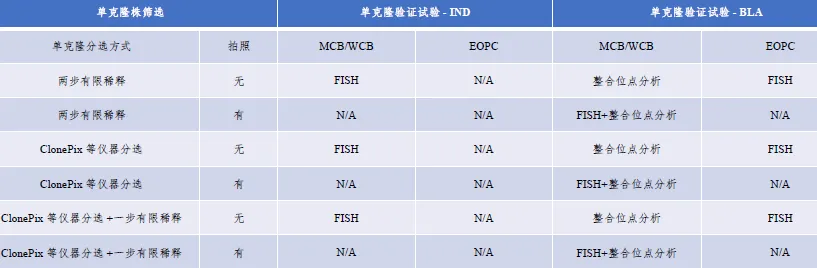
临床试验申报和BLA申报对单克隆性的一般考虑
根据申报经验,IND阶段可以采用有限稀释的单克隆方法+拍照的方式, 证明其单克隆性。
目前对单克隆性概率尚没有明确限值要求, 但申请人应该在克隆化之前预设单克隆概率, 并按照该目标开展研究。通常在合适稀释水平 (如每孔0.5 个细胞) 进行两轮有限稀释可以达到95% 的单克隆概率。
原则上, 单纯缺乏单克隆性确认不应阻碍临床进程。克隆化确认可结合临床进程深入研究。
BLA阶段采用至少两轮有限稀释(0.5call/well)+其他方法证明其单克隆性。