

第2课时 离子反应在化工流程中的应用
[核心素养发展目标] 1.了解常考化工流程题的一般形式。2.能从“电离平衡、水解平衡、沉淀溶解平衡”的视角分析化工生产的相关问题。
1.工艺流程题的一般呈现形式
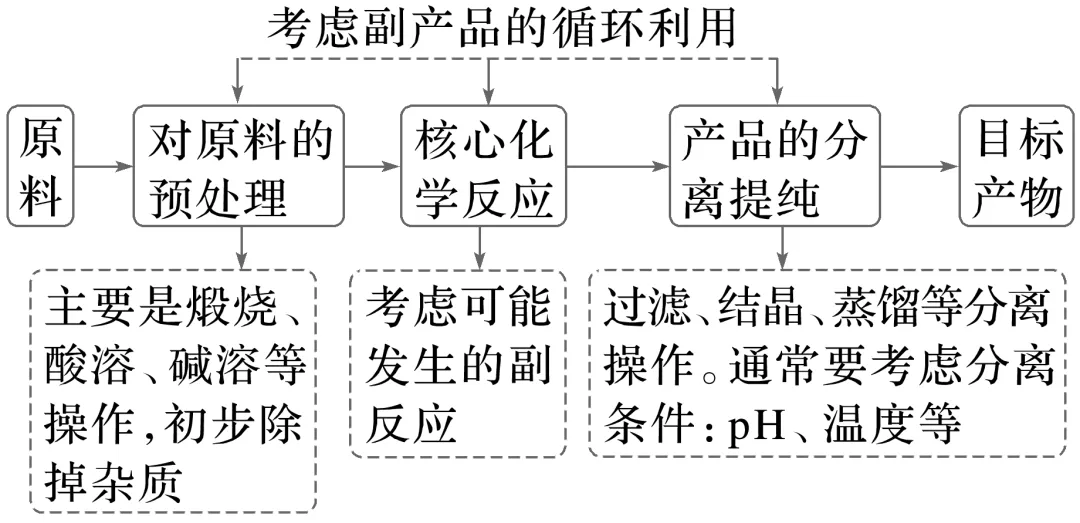
2.工艺流程题解题思路
(1)审题流程
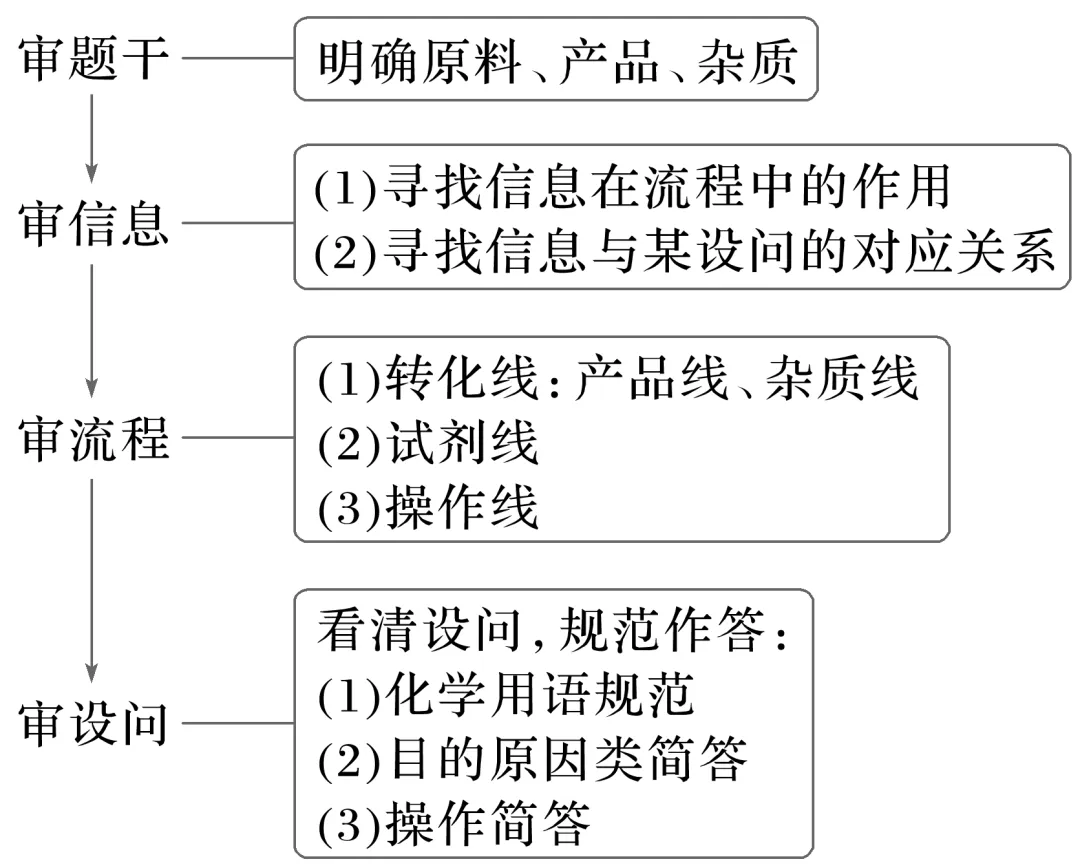
(2)识图技巧
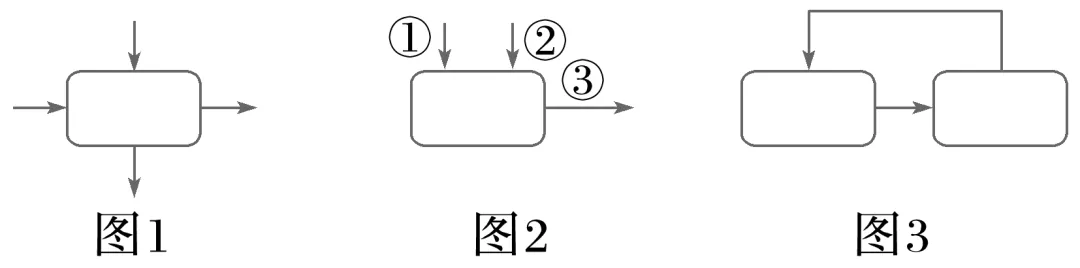
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
3.典例剖析
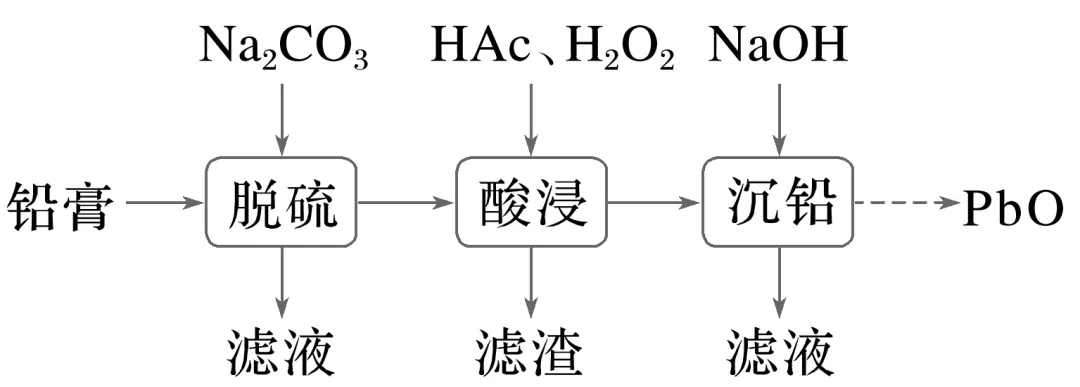
例1(2022·全国乙卷,26)废旧铅酸蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
Ksp | 2.5× 10-8 | 7.4× 10-14 | 1.1× 10-10 | 2.6× 10-9 |
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为________________________________,
用沉淀溶解平衡原理解释选择Na2CO3的原因:________________________________。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是____________
_________________________________________________________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是_________________________________________________;
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为_______________
________________________________________________________________________;
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是__________________________。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________________。
(5)“沉铅”的滤液中,金属离子有________。
 铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,过滤后,向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,过滤后,向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
例2(2023·山东,17)盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、SO2-4和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备Li2CO3的工艺流程如下:
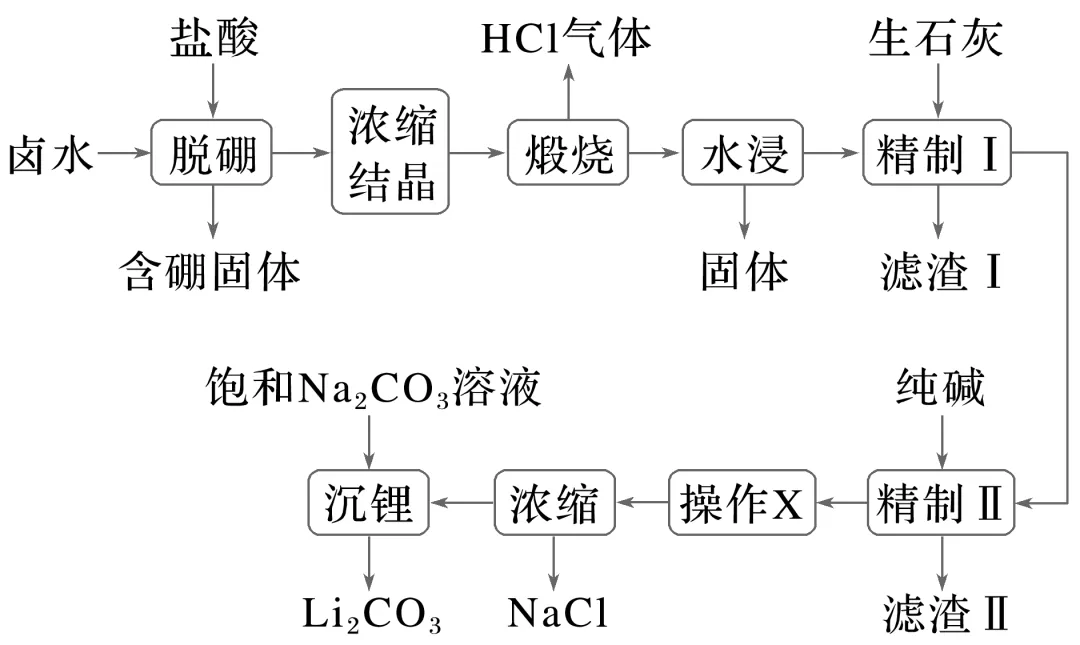
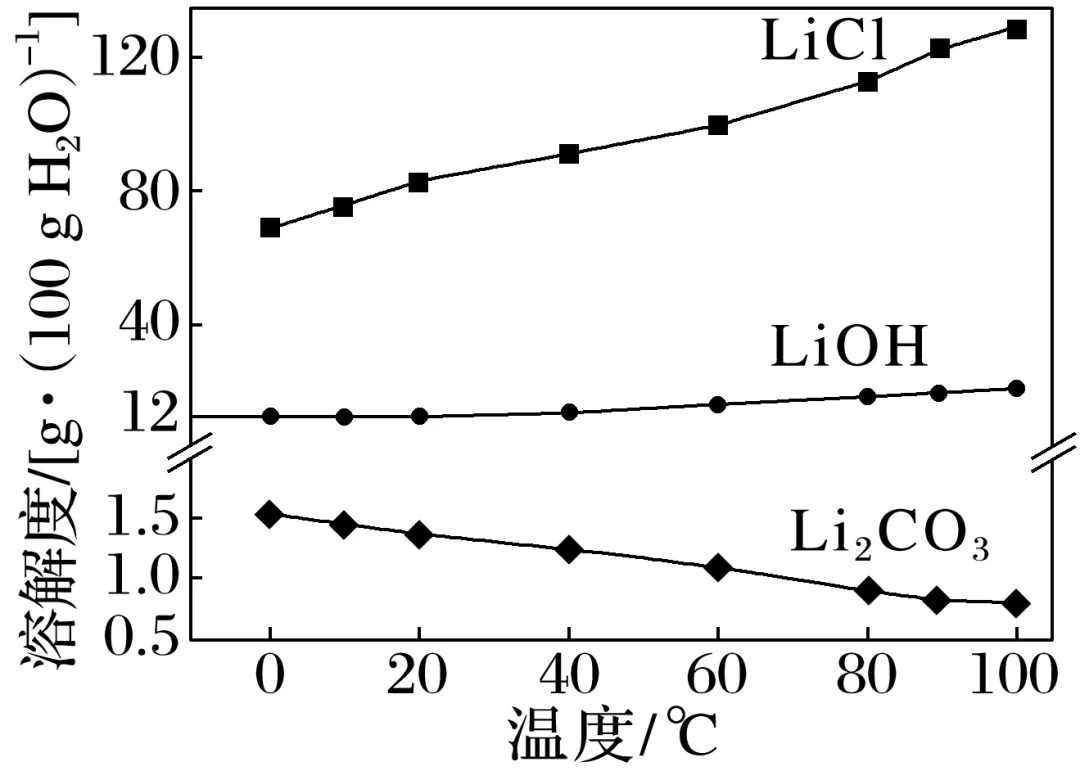
已知:常温下,Ksp(Li2CO3)=2.2×10-2。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:B(OH)3+H2OH++\a\vs4\al\co1(BOH4)-(常温下,Ka=10-9.24);B(OH)3与NaOH溶液反应可制备硼砂Na2B4O5(OH)4·8H2O。常温下,在0.10 mol·L-1硼砂溶液中,\a\vs4\al\co1(B4O5OH4)2-水解生成等物质的量浓度的B(OH)3和\a\vs4\al\co1(BOH4)-,该水解反应的离子方程式为_______________________________________________________________,
该溶液pH=__________。
(2)滤渣 Ⅰ 的主要成分是_______________________________________________________
(填化学式);精制 Ⅰ 后溶液中Li+的浓度为2.0 mol·L-1,则常温下精制 Ⅱ 过程中CO2-3浓度应控制在__________________mol·L-1以下。若脱硼后直接进行精制 Ⅰ,除无法回收HCl外,还将增加__________________(填化学式)的用量。
(3)精制 Ⅱ 的目的是________________________________________________________;
进行操作X时应选择的试剂是________,若不进行该操作而直接浓缩,将导致________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。

1.实验小组设计实验除去粗盐溶液中的Ca2+、Mg2+、SO2-4并进行定性检验。
已知:Ksp[Mg(OH)2]=5.6×10-12,Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。
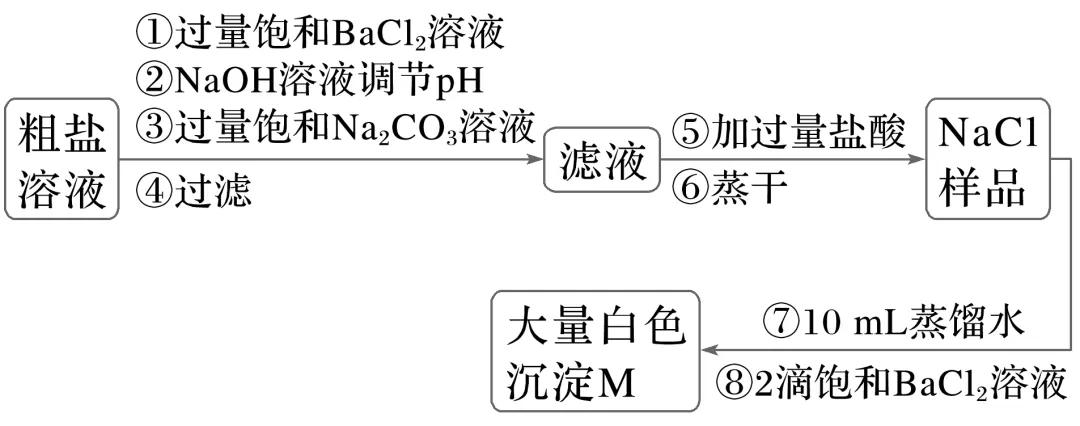
下列说法不正确的是( )
A.常温时,调节溶液的pH>12,可使滤液中c(Mg2+)<1×10-5mol·L-1
B.加入Na2CO3溶液仅发生反应:Ba2++CO2-3===BaCO3↓、Ca2++CO2-3===CaCO3↓
C.加入盐酸发生的反应是2H++CO2-3===CO2↑+H2O、H++OH-===H2O
D.若步骤①加入BaCl2溶液后进行过滤,可以避免白色沉淀M的生成
2.(2023·山西忻州高二月考)四水合磷酸锌[Zn3(PO4)2·4H2O,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下:
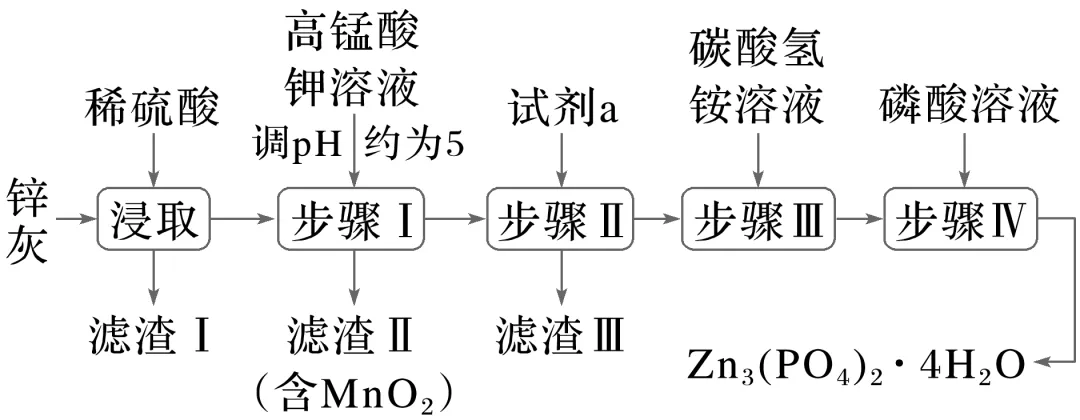
已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36。
下列说法错误的是( )
A.滤渣 Ⅰ 的主要成分是SiO2
B.步骤 Ⅰ 中,调节溶液的pH约为5后加KMnO4溶液反应的离子方程式为MnO-4+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+
C.若试剂a为ZnS,反应ZnS(s)+Cu2+(aq)===Zn2+(aq)+CuS(s)的K=2.5×1011
D.沉锌后的母液中可回收利用的物质有K2SO4、(NH4)2SO4
3.钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及活性炭)为原料制取钴的氧化物的流程如下。
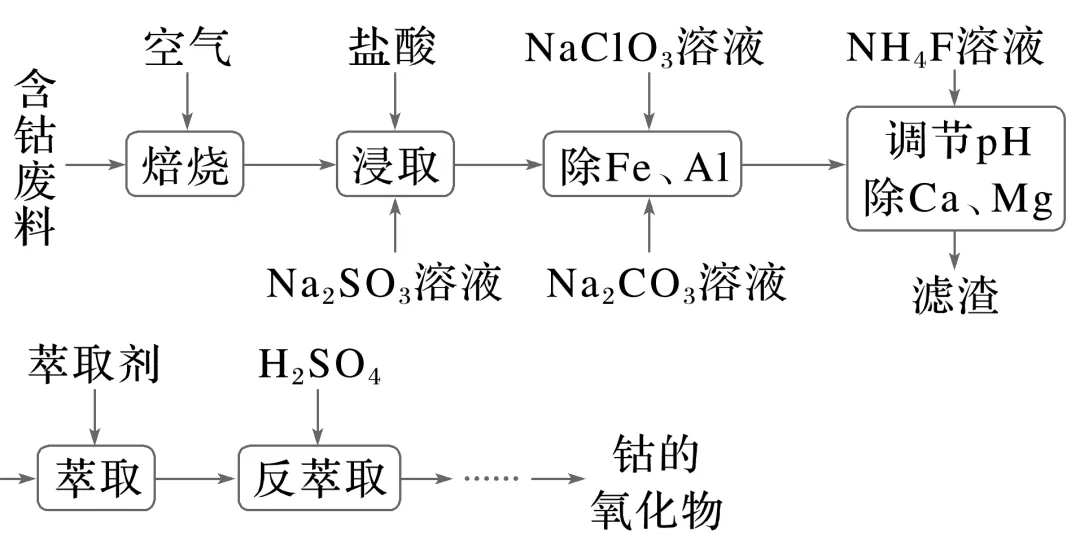
已知:萃取时发生的反应为Co2++n(HA)2CoA2·(n-1)(HA)2+2H+。
(1)除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:_____________________________________________________________
________________________________________________________________________。
(2)除Ca、Mg:当某离子浓度c≤1×10-6 mol·L-1时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥________mol·L-1。
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是________________________________________________________________________
________________________________________________________________________。
[Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,Ka(HF)=3.5×10-4]
(3)萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
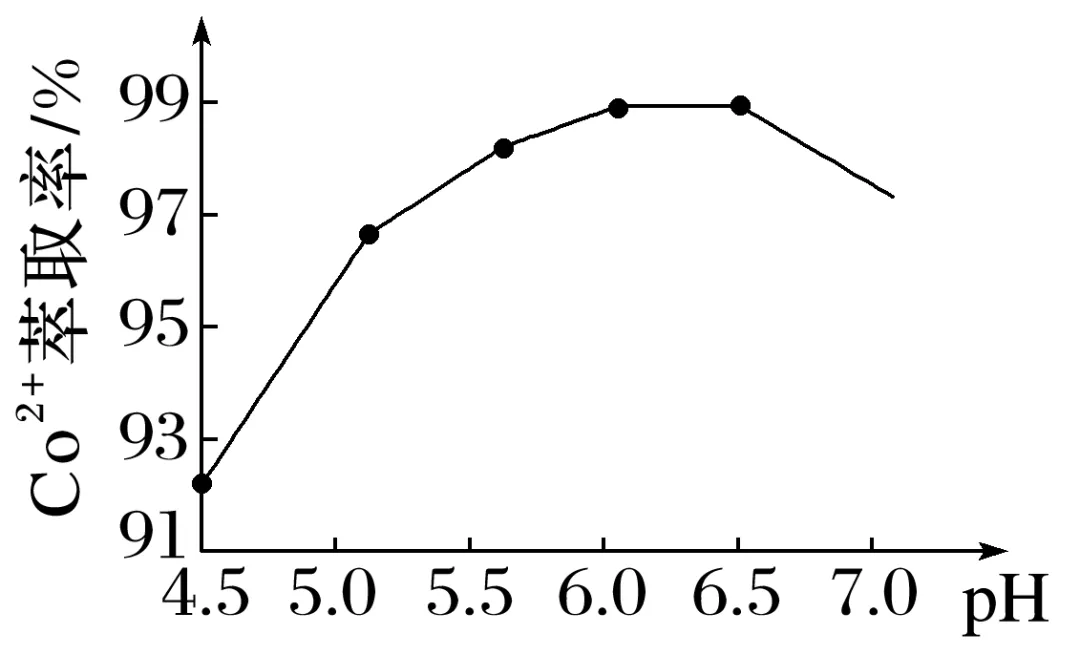
①该工艺中设计萃取、反萃取的目的是________________________________。
②Co2+萃取率随pH升高先增大后减小的可能原因是_______________________________。

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1WiBBQCVHpFgaci5JN4S3LA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享