 n
n
第2课时 化学反应与电能
[核心素养发展目标] 1.设计实验认识构成原电池的条件。2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。3.了解原电池工作原理的应用。
一、原电池构成条件及工作原理
1.火力发电——化学能间接转化为电能
化学能热能机械能电能
其中能量转换的关键环节是燃烧(氧化还原反应)。
思考1 火力发电的缺点是什么?
提示①煤炭是不可再生能源,会造成能源危机;②煤炭燃烧会产生污染性气体;③经多次转换,能量损耗大,燃料的利用率低。
2.原电池——化学能直接转化为电能
(1)实验探究
实验装置 |
|
|
|
实验现象 | 铜片:没有变化 锌片:逐渐溶解,有气泡产生 | 铜片:有气泡产生 锌片:逐渐溶解 | 电流表:指针发生偏转 |
实验结论 | 锌与稀硫酸反应产生氢气,而铜与稀硫酸不反应 | 锌失去电子,经导线流向铜片,H+在铜片上得到电子被还原生成H2 | 导线中有电流通过,反应过程中产生了电能 |
(2)原电池
①概念:将化学能转化为电能的装置。
②本质:发生氧化还原反应。
③电极:负极:电子流出的一极,发生氧化反应;
正极:电子流入的一极,发生还原反应。
(3)原电池工作原理
思考2 结合上述实验和课本原电池原理示意图,分析说明该原电池的电极和导线、电解质溶液中的导电微粒分别是什么,并说明其移动方向。
提示电极(锌片、铜片)和导线中的导电微粒是电子,从负极流出,经导线流向正极;电解质溶液中的导电微粒是阳离子H+、阴离子S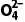 ,阳离子向正极移动,阴离子向负极移动。
,阳离子向正极移动,阴离子向负极移动。
总结
原电池总反应式:Zn+2H+===Zn2++H2↑。
(4)原电池的构成条件
思考3 (1)图1装置中的铜起什么作用?铜能否用锌代替?铜能用什么物质代替?
提示铜作正极,能导电。若用锌代替铜,两极活泼性相同,不能构成原电池。能用石墨、较不活泼的金属等代替铜。
(2)图2中将锌片换成铜,能形成原电池吗?
提示不能,无自发进行的氧化还原反应。
(3)图2中用酒精代替稀硫酸能形成原电池吗?
提示不能,酒精是非电解质,不导电。
总结
1.判断正误
(1)火力发电过程中,机械能转化为电能是整个能量转化的关键( )
(2)原电池的电极材料必须是金属( )
(3)原电池工作时,正极与负极转移电子数相同( )
(4)在锌铜原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液流回锌( )
答案 (1)× (2)× (3)√ (4)×
2.按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为(填电极名称),判断依据:;
铜电极的名称是,溶液中的Cu2+移向(填“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为(填电极名称),判断依据:; 铜电极的名称是,溶液中的Ag+移向(填“Cu”或“X”)电极。X电极上的电极反应式为。
答案 (1)负极 锌的活泼性比铜强(或Zn的还原性比Cu强) 正极 Cu
(2)正极 铜的活泼性比银强(或Cu的还原性比Ag强) 负极 X Ag++e-===Ag

电极名称的判断方法
二、原电池工作原理的应用
思考用Zn和稀硫酸反应制氢气时,为了使反应加快,常常加入少量CuSO4溶液,请问这是为什么?
提示锌和置换出的铜、稀硫酸构成了原电池,可以加快反应进行。
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
2.比较金属的活动性
一般,若两种金属A、B与电解质溶液构成原电池,若金属A作负极,则金属活动性:A>B。
3.设计原电池
(1)给定氧化还原反应设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
如:利用Cu+2AgNO3===Cu(NO3)2+2Ag的氧化还原反应可设计原电池。
该电池负极为Cu,电极反应式为Cu-2e-===Cu2+,正极为石墨(C),电极反应式为2Ag++2e-===2Ag。
(2)简易电池的设计与制作
根据原电池原理,设计水果电池和制作简易电池,体会原电池的构成要素。
例 同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题] 影响自制电池效果的因素有哪些?
[查阅资源] 电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究] Ⅰ.按如图连接水果电池。
Ⅱ.实验记录如下:
序号 | 电极 | 电极间距 | 水果种类 | 电流表示数(μA) |
① | Cu—Al | 2.0 cm | 西红柿 | 78.5 |
② | Cu—Fe | 2.0 cm | 西红柿 | 70.3 |
③ | Al—Al | 2.0 cm | 西红柿 | 0 |
④ | Cu—Al | 2.0 cm | 柠檬 | 45.7 |
⑤ | Cu—Al | 1.0 cm | 柠檬 | 98.4 |
⑥ | 石墨棒—Al | 1.0 cm | 柠檬 | 104.5 |
[解释与结论]
(1)实验①②③的目的是。
对比实验①②③得出的结论是。
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验(填序号)。对比④⑤得出的结论是。
[反思与探讨]
(3)水果电池中,水果的作用是。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为, 构成水果电池的其他要素还有、、。
答案 (1)探究电极材料对电池效果的影响 在其他条件相同时,电极材料活泼性差别越大,电池效果越好 (2)①④ 在其他条件相同时,电极间距越小,电流越大,电池效果越好 (3)作电解质溶液
(4)两极金属活动性不同 能发生自发的氧化还原反应 形成闭合回路 有电解质溶液
1.判断正误
(1)原电池中,负极材料的活动性一定强于正极材料的活动性( )
(2)只要是自发的放热的化学反应就可以设计为原电池( )
(3)原电池的负极上一定发生氧化反应,故负极本身质量一定减轻( )
(4)原电池中正极材料必须与电解质溶液的某种离子反应( )
答案 (1)× (2)× (3)× (4)×
2.现有如下两个反应:
A:H2SO4+2KOH===K2SO4+2H2O
B:Cu+2FeCl3===CuCl2+2FeCl2
(1)根据上述两个反应的本质,(填字母)反应能设计成原电池,其原因是。
(2)将上述反应中能设计成原电池的反应设计成原电池。
①写出电极反应式及反应类型:
负极: , ;
正极: , 。
②画出装置图并标明电极材料、电解质溶液和电子流向。
③若导线上通过2 mol电子,则负极质量减轻g。
答案 (1)B A为非氧化还原反应,没有电子转移;B为氧化还原反应,有电子转移 (2)①Cu-2e-===Cu2+ 氧化反应 2Fe3++2e-===2Fe2+ 还原反应
②
③64
1.(2023·辽宁抚顺高一校联考期中)下列各组材料组成如图装置,电流表指针能发生偏转的是( )
选项 | A | B | C | D |
M | 石墨 | Zn | Fe | Al |
N | Ag | Ag | Cu | Al |
P | 稀硫酸 | 蔗糖溶液 | FeCl3溶液 | NaOH溶液 |
答案 C
解析 Ag、石墨与稀硫酸都不反应,不能构成原电池,电流表指针不能发生偏转,故不选A;蔗糖是非电解质,蔗糖溶液不导电,不能构成原电池,电流表指针不能发生偏转,故不选B;铁的活泼性大于铜,铁与氯化铁反应生成氯化亚铁,Fe、Cu、FeCl3溶液构成原电池,电流表指针能发生偏转,故选C;M、N两个电极相同,不能构成原电池,电流表指针不能发生偏转,故不选D。
2.(2024·石家庄高一期中)某化学兴趣小组设计了一个如图所示的水果电池,下列有关该电池的说法正确的是( )

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享