

模块综合试卷(一)[分值:100分]
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题目要求)
1.(2023·河南洛阳高一联考)化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
A.聚丙烯腈纤维可用于制毛毯和毛线,聚丙烯腈纤维是有机高分子材料
B.长征五号火箭的箭体蒙皮材料为2219⁃铝合金,2219⁃铝合金可一定程度上减轻火箭的重量
C.2022年北京冬奥会吉祥物“冰墩墩”的主要材料为聚乙烯,聚乙烯能发生加成反应
D.可折叠柔性屏中的“灵魂材料”(纳米银)进入水体中会造成水污染
答案 C
解析聚乙烯分子中不含有不饱和键,不能发生加成反应,C错误。
2.下列关于合理用药和食品添加剂的说法正确的是( )
A.处方药的包装上印有“OTC”标识
B.为了使婴儿对食品有浓厚兴趣,可以在婴儿食品中添加大量着色剂
C.为了提高奶制品中蛋白质的含量可添加三聚氰胺
D.味精能增加食品的鲜味,是一种常用的增味剂,其化学名称为谷氨酸钠
答案 D
解析非处方药的包装上印有“OTC”标识,A错误;我国法律规定,婴儿食品中禁止添加任何食品添加剂,B错误;三聚氰胺有毒,不能用作食品添加剂,C错误;味精是谷氨酸的一种钠盐,化学名称为谷氨酸钠,是一种安全调味剂,D正确。
3.(2024·福建莆田高一下期中)下列说法正确的是( )
A.有机物都易溶于有机溶剂,难溶于水
B.石油裂解可得到乙烯
C.甲烷和乙烯互为同系物
D.乙烯、乙炔、苯均能通过加成反应使溴水中的水层褪色
答案 B
解析大多数有机物都易溶于有机溶剂,难溶于水,但乙醇、乙酸等有机物易溶于水,A错误;甲烷和乙烯结构不相似,两者不互为同系物,C错误;乙烯、乙炔均能通过加成反应使溴水中的水层褪色,但苯不能和溴水发生加成反应,只能萃取溴水中的溴而使水层褪色,D错误。
4.(2023·太原五中高一月考)下列说法正确的是( )
A.乙烷中混有乙烯,可在一定条件下通入氢气,使乙烯转化为乙烷
B.CH3N:,该物质的分子式及结构式从成键情况看是合理的
C.光照条件下,氯气与乙烷发生反应,生成的产物肯定有7种
D.分子式为C7H16的烷烃,分子中有3个甲基结构和4个甲基结构的同分异构体分别有3种和4种(不考虑立体异构)
答案 D
5.下列有关实验的操作、现象和实验结论错误的是( )
选项 | 操作 | 现象 | 实验结论 |
A | 将SO2通入酸性KMnO4溶液 | 溶液褪色 | SO2具有还原性 |
B | 将SO2通入H2S溶液 | 产生淡黄色沉淀 | SO2具有氧化性 |
C | 向蔗糖中加入浓硫酸,将产生的气体通入溴水 | 蔗糖膨胀变黑,溴水褪色 | 浓硫酸具有脱水性和氧化性 |
D | 将淀粉与稀硫酸混合加热后,加入少量新制的Cu(OH)2,再加热 | 无砖红色沉淀生成 | 淀粉没有水解,或水解后没有葡萄糖生成 |
答案 D
解析 SO2将KMnO4还原为Mn2+,溶液褪色,说明SO2具有还原性,故A正确;SO2+2H2S===3S↓+2H2O,产生淡黄色沉淀,说明SO2具有氧化性,故B正确;向蔗糖中加入浓硫酸,浓硫酸使蔗糖脱水炭化并放热,浓硫酸与碳反应生成CO2和SO2,则蔗糖变黑、膨胀,SO2能将溴还原而使溴水褪色,浓硫酸体现脱水性和强氧化性,故C正确;将淀粉与稀硫酸混合加热后,应先加入NaOH溶液中和稀硫酸,然后再加新制的Cu(OH)2,才能检验有无葡萄糖生成,故D错误。
6.(2023·济南高一期末)利用太阳光在新型复合催化剂表面实现高效分解水,其主要过程如图所示:
则下列说法错误的是( )
A.过程中实现了光能转化为化学能
B.氢能资源丰富,属于可再生能源
C.过程Ⅰ吸收能量,过程Ⅱ释放能量
D.2H2O2H2↑+O2↑反应的能量变化如图所示:
答案 D
解析水分解成氢气和氧气需吸收能量,则用太阳光在新型复合催化剂表面实现高效分解水过程中实现了光能转化为化学能,A正确;过程Ⅰ为化学键的断裂,吸收能量,过程Ⅱ为化学键的形成,释放能量,C正确;2H2O2H2↑+O2↑反应时吸收能量,图示代表放热反应,D错误。
7.利用氮元素的价—类二维图可以设计氮及其化合物之间的转化路径,下列说法不正确的是( )
A.工业固氮的常用方法是由N2和H2合成NH3
B.可利用Cu与硝酸的反应,将N元素转化为NO或NO2
C.由氮气转化为含氮化合物的反应中,必须提供氧化剂
D.实验室可利用氢氧化钙固体与NH4Cl固体混合加热制备NH3
答案 C
解析氮的固定是将游离态的氮转化为含氮化合物的过程,工业固氮的常用方法是由N2和H2合成NH3,故A正确;铜与稀硝酸反应生成NO,铜与浓硝酸反应生成NO2,故B正确;氮气生成氨气的过程中需要还原剂,故C错误。
8.(2023·青岛高一期中)空气吹出法是海水提溴的常用方法,其工艺流程如图所示,下列说法错误的是( )
A.热空气吹出Br2,利用了溴的挥发性
B.通Cl2发生的主要反应均为Cl2+2Br-===2Cl-+Br2
C.该流程体现出氧化性强弱:Cl2>SO2>Br2
D.溴水混合物1到溴水混合物2的目的是富集溴元素
答案 C
解析由溴与二氧化硫吸收液反应生成硫酸和氢溴酸可知,氧化剂溴的氧化性强于还原剂二氧化硫,C错误。
9.(2023·石家庄高一月考)山梨酸是常用的食品防腐剂,其结构简式如图所示,下列有关山梨酸的叙述错误的是( )
A.既能发生取代反应,又能发生加成反应
B.分子中所有碳原子可能在同一平面上
C.与互为同分异构体
D.1 mol 该物质与足量Na反应生成3 g H2
答案 B
解析山梨酸分子中含羧基和羟基,能发生取代反应,含碳碳双键,能发生加成反应,A正确;羧基所连的饱和碳原子为四面体结构,则分子中所有碳原子不可能在同一平面上,B错误;山梨酸与的分子式均为C7H10O5,结构不同,则二者互为同分异构体,C正确;山梨酸分子中含羧基和羟基,均能与Na反应产生氢气,则1mol 该物质与足量Na反应生成3gH2,D正确。
10.一定温度下,向2 L恒容密闭容器中充入0.4 mol NH3和0.5 mol O2发生反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)。2 min末,NO的物质的量为0.2 mol 。下列有关说法不正确的是( )
A.2 min末,NH3的浓度为0.1 mol ·L-1
B.0~2 min内,用NH3表示的平均反应速率为v(NH3)=0.05 mol ·L-1·min-1
C.2 min末,生成水的物质的量为0.3 mol
D.继续反应达平衡后,NO的浓度可以达到0.2 mol ·L-1
答案 D
解析 2min末,NO的物质的量为0.2mol ,则消耗NH30.2mol ,NH3的物质的量为0.4mol-0.2mol=0.2mol ,容器体积为2L,则NH3的浓度为0.1mol·L-1,故A正确;0~2min内,用NH3表示的平均反应速率v(NH3)=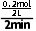 =0.05mol·L-1·min-1,故B正确;根据反应方程式,生成0.2molNO的同时生成0.3mol水,故C正确;若0.4molNH3完全反应,则生成0.4molNO,浓度为0.2mol·L-1,但该反应是可逆反应,不能进行到底,所以达平衡后,NO的浓度不能达到0.2mol·L-1,故D错误。
=0.05mol·L-1·min-1,故B正确;根据反应方程式,生成0.2molNO的同时生成0.3mol水,故C正确;若0.4molNH3完全反应,则生成0.4molNO,浓度为0.2mol·L-1,但该反应是可逆反应,不能进行到底,所以达平衡后,NO的浓度不能达到0.2mol·L-1,故D错误。
11.(2023·长沙高一期末)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12 L O2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mLB.50 mL
C.40 mLD.25 mL
答案 B
解析 1.12LO2的物质的量为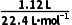 =0.05mol ,根据题意,Cu失电子给了HNO3生成NO和NO2,NO和NO2又失电子给了O2生成HNO3,该过程中相当于HNO3未得到电子,结果仅是Cu失电子给了O2,根据得失电子守恒知,n(Cu)=2n(O2),故n(Cu)=0.1mol,根据关系式Cu~Cu2+~2OH-~2NaOH可得,n(NaOH)=2n(Cu)=0.2mol,V(NaOH)=
=0.05mol ,根据题意,Cu失电子给了HNO3生成NO和NO2,NO和NO2又失电子给了O2生成HNO3,该过程中相当于HNO3未得到电子,结果仅是Cu失电子给了O2,根据得失电子守恒知,n(Cu)=2n(O2),故n(Cu)=0.1mol,根据关系式Cu~Cu2+~2OH-~2NaOH可得,n(NaOH)=2n(Cu)=0.2mol,V(NaOH)=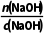 =
=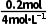 =0.05L=50mL。
=0.05L=50mL。
12.某学习小组为探究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。
下列说法不正确的是( )
A.反应开始前通入过量的CO2气体,目的是排出装置内的空气
B.A中发生反应的离子方程式为Cu+2N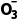 +4H+===Cu2++2NO2↑+2H2O
+4H+===Cu2++2NO2↑+2H2O
C.当B中0.03 mol铜粉被氧化时,B中产生的NO气体大于0.02 mol
D.C装置中装入一定量的水进行尾气处理
答案 D
解析为便于观察B中生成无色气体,防止NO被氧化,则开始前通入过量的CO2气体,目的是排出装置内的空气,故A正确;A中Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,则离子反应为Cu+2N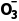 +4H+===Cu2++2H2O+2NO2↑,故B正确;B中0.03molCu被氧化时,由电子守恒可知生成的NO为
+4H+===Cu2++2H2O+2NO2↑,故B正确;B中0.03molCu被氧化时,由电子守恒可知生成的NO为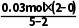 =0.02mol,且二氧化氮与水反应生成NO,即B中产生的NO气体大于0.02mol,故C正确;NO与水不反应,不能用水进行尾气处理,C中应装入NaOH溶液,故D错误。
=0.02mol,且二氧化氮与水反应生成NO,即B中产生的NO气体大于0.02mol,故C正确;NO与水不反应,不能用水进行尾气处理,C中应装入NaOH溶液,故D错误。
13.(2024·安徽铜陵月考)一种NO⁃空气燃料电池的工作原理如图所示,该电池工作时,下列说法正确的是( )
A.负极的电极反应式为NO-3e-+2H2O===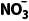 +4H+
+4H+
B.H+通过质子交换膜向左侧多孔石墨棒移动
C.若产生1 mol HNO3,则通入O2的体积应等于16.8 L
D.电子由左侧多孔石墨棒极经过负载移向右侧多孔石墨棒极,再经过溶液移回左侧多孔石墨棒极
答案 A
解析由题干图示装置可知,NO失去电子转化为HNO3,电极反应为NO-3e-+2H2O===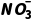 +4H+,故左侧多孔石墨电极为负极,O2在右侧多孔石墨电极上得到电子,即右侧多孔石墨电极为正极,电极反应为O2+4H++4e-===2H2O,A正确;原电池中阳离子向正极移动,则H+通过质子交换膜向右侧多孔石墨棒移动,B错误;未说明O2所处的温度和压强,无法计算其体积,C错误;原电池中电子从负极经导线流向正极,电子不能进入溶液,D错误。
+4H+,故左侧多孔石墨电极为负极,O2在右侧多孔石墨电极上得到电子,即右侧多孔石墨电极为正极,电极反应为O2+4H++4e-===2H2O,A正确;原电池中阳离子向正极移动,则H+通过质子交换膜向右侧多孔石墨棒移动,B错误;未说明O2所处的温度和压强,无法计算其体积,C错误;原电池中电子从负极经导线流向正极,电子不能进入溶液,D错误。
14.(2024·河南新乡月考)有机物P是调节血脂药物的中间体,其结构如图所示。下列有关P的描述不正确的是( )
A.含有三种官能团
B.能发生加成反应、酯化反应和氧化反应
C.1 mol P与足量Na反应可放出2.5 mol H2
D.可使酸性KMnO4溶液和溴水褪色,且褪色原理相同
答案 D
解析 P含有羟基、碳碳双键和羧基三种官能团,因此其能发生加成反应、酯化反应和氧化反应,A、B正确;P分子中含有4个羟基和1个羧基,因此,1molP与足量Na反应可放出2.5molH2,C正确;使酸性KMnO4溶液褪色是P具有还原性,使溴水褪色是因为P有碳碳双键,发生了加成反应,故两者褪色原理不相同,D

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享