n
第二节 分子的空间结构
第1课时 分子结构的测定和多样性 价层电子对互斥模型
[核心素养发展目标]1.了解分子结构的测定方法。2.通过对典型分子空间结构的学习,认识微观结构对分子空间结构的影响,了解共价分子结构的多样性和复杂性。3.通过对价层电子对互斥模型的探究,建立解决复杂分子结构判断的思维模型。
一、分子结构的测定
科学家应用光谱、晶体等方法测定分子结构,应用测定分子的相对分子质量。
1.红外光谱
(1)原理
当一束红外线透过分子时,分子会吸收跟它的某些的红外线,再记录到图谱上呈现。通过和已有谱图库,或通过量子化学,可分析出分子中含有何种或的信息。
(2)红外光谱仪原理示意图
(3)实例
某未知物的红外光谱图:
通过红外光谱图可知,该物质中有、、化学键,并推测可能含有官能团。
2.相对分子质量的确定——质谱法
甲苯分子的质谱图:
读谱:相对分子质量=最大质荷比,甲苯的相对分子质量为。
1.如图所示是某分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为( )
A.CH3COOCH2CH3
B.CH3CH2CH2COOH
C.HCOOCH2CH2CH3
D.(CH3)2CHCH2COOH
2.如图是有机物A的质谱图,则A的相对分子质量是( )
A.29B.43
C.57D.72
二、多样的分子空间结构
观察下列几种简单的分子的空间结构模型。
| 化学式 | 电子式 | 结构式 | 键角 | 分子的空间结构 |
三原子分子 | CO2 | | | | |
H2O | | | | |
四原子分子 | BF3 | | | | |
NH3 | | | | |
CH2O | | | | |
五原子分子 | CH4 | | | | |
CH3Cl | | | — | |
四原子分子都是平面三角形或三角锥形吗?
1.正误判断
(1)所有的三原子分子都是直线形结构( )
(2)正四面体形的键角均为109°28'( )
(3)SiCl4、SiH4、N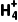 、CH3Cl均为正四面体结构( )
、CH3Cl均为正四面体结构( )
(4)SF6分子的空间结构为正八面体形( )
(5)椅式C6H12比船式C6H12稳定( )
2.下列有关键角与分子空间结构的说法不正确的是( )
A.键角为180°的分子,空间结构是直线形
B.键角为120°的分子,空间结构是平面三角形
C.键角为60°的分子,空间结构可能是正四面体形
D.键角为90°~109°28'之间的分子,空间结构可能是V形
3.(1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为。
(2)二硫化碳(CS2)分子中,两个C S的夹角是180°,说明CS2分子的空间结构为。
S的夹角是180°,说明CS2分子的空间结构为。
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是(填字母)。
a.两个键之间的夹角为109°28'
b.C—H为极性共价键
c.4个C—H的键能、键长都相等
d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
几种常见分子的空间结构
(1)常见的空间结构为直线形的分子有BeCl2、HCN、C2H2、CO2等。
(2)常见的空间结构为V形的分子有H2O、H2S、SO2等。
(3)常见的空间结构为平面三角形的分子有BF3、SO3、HCHO等。
(4)常见的空间结构为三角锥形的分子有PH3、PCl3、NH3等。
(5)常见的空间结构为正四面体形的分子有CH4、CCl4、SiH4、SiF4等;是四面体形但不是正四面体形的有CH3Cl、CH2Cl2、CHCl3等。
三、价层电子对互斥模型
1.价层电子对互斥模型(VSEPRmodel)
对ABn型的分子或离子,中心原子A的价层电子对(包括成键的和未成键的)之间由于存在排斥力,将使分子的空间结构总是采取电子对相互排斥最弱的那种结构,以使彼此之间斥力最小,分子或离子的体系能量最低,最稳定。
2.价层电子对的计算
(1)中心原子价层电子对数=σ键电子对数+孤电子对数。
(2) σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几个σ键电子对。如H2O分子中, O有个σ键电子对,NH3分子中, N有个σ键电子对。
(3)中心原子上的孤电子对数的计算
①中心原子上的孤电子对数=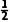 (a-xb)
(a-xb)
ⅰ.a表示中心原子的价电子数。具体情况如下表所示:
对象 | 公式 |
主族元素 | a=原子的最外层电子数 |
阳离子 | a=中心原子的价电子数-离子的电荷数 |
阴离子 | a=中心原子的价电子数+离子的电荷数(绝对值) |
ⅱ.x表示与中心原子结合的原子数。
ⅲ.b表示与中心原子结合的原子最多能接受的电子数。
②几种常见分子或离子的中心原子上的孤电子对数如下表所示:
分子或离子 | 中心原子 | a | x | b | 中心原子上的孤电子对数 |
SO2 | S | 6 | 2 | 2 | 1 |
NH3 | N | 5 | 3 | 1 | 1 |
N | N | 5-1=4 | 4 | 1 | 0 |
C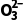 | C | 4+2=6 | 3 | 2 | 0 |
3.价层电子对的空间结构(即VSEPR模型)
4.VSEPR模型的应用——预测分子或离子的空间结构
(1)基本思路
对于ABn型分子,利用VSEPR模型推测分子或离子空间结构的思路如下:
(2)具体实例
①中心原子不含孤电子对
分子或 离子 | 中心原子的 价层电子对数 | VSEPR模 型及名称 | 分子或离子的 空间结构及名称 |
CO2 | |
直线形 |
直线形 |
C | |
平面三角形 |
平面三角形 |
CH4 | |
正四面体形 |
正四面体形 |

通过网盘分享的文件:同步PPT课件等3个文件
链接: https://pan.baidu.com/s/1aX91ROOZJC0j7zSsZs4sQQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享