2026-1-20今日读书:眼底病学学习笔记(第一章第三节 眼底病遗传学基础)
- 2026-02-09 20:18:20
2026-1-18今日读书:眼底病学学习笔记(第一章 第一节 视网膜色素上皮RPE)
2026-1-19今日读书:眼底病学学习笔记(第一章 第二节 脉络膜)
学习背景:因眼科医疗设备工作需求(超广角、OCT相关),系统学习眼底病学,本章为第一章第三节,是眼底病学“遗传机制-设备关联-临床应用”的核心知识模块,需完成“知识精读+必背标注+设备关联+拓展补充”的学习目标。
学习定位:以“遗传概念-技术方法-疾病遗传特征-设备关联-临床应用”为逻辑主线,串联眼科设备实操的知识节点,标注「精读记忆」「精准背诵」层级,补充设备相关拓展点,适配“理解-背诵-工作应用”三层目标。
一、章节核心框架(请速记)
本章节核心围绕“遗传概念-技术方法-疾病遗传特征-病理-设备关联-临床应用”展开,是眼底病学“遗传机制与设备观测”的基础模块,也是超广角、OCT设备识别遗传相关性眼底病影像特征的理论依据。
逻辑链:遗传概念/技术→眼底病遗传特征→病理变化→临床疾病→设备通过影像特征捕捉遗传病变的结构/功能异常。
二、核心知识点解读+必背标注+设备关联
(一)分子遗传学基础定位与核心概念【精准背诵+设备关联核心】
1. 核心知识点解读
遗传学是研究眼底病“基因-表型”关联的基础,核心概念包括基因组、基因、基因结构等,是理解遗传相关性眼底病的前提:
•基因组:细胞/生物体的全套遗传物质,人类单倍体基因组由3.2×10⁹碱基对(bp)的DNA组成,分为两类:
◦细胞核染色体基因组:约90%为重复序列,仅10%为单拷贝序列,其中5%为编码序列,最终编码约3万个基因;
◦线粒体基因组(mtDNA):独立的环状双链DNA,无内含子,编码37个基因(含与氧化磷酸化相关的蛋白,其突变可导致视网膜神经节细胞能量代谢异常)。
•基因:染色体DNA上携带遗传信息的特定序列,通过“转录(DNA→mRNA)-翻译(mRNA→蛋白质)”表达产物;不同细胞选择性表达基因(如视网膜视杆细胞特异性表达RHO基因,视锥细胞特异性表达OPN1LW基因)。
•基因结构:真核生物基因包含外显子(编码蛋白质的序列)、内含子(非编码序列)、启动子(调控转录起始)、增强子(增强转录效率);转录生成的前体mRNA需经“剪接”去除内含子,形成成熟mRNA后翻译为蛋白质(如RHO基因的前体mRNA含5个外显子,剪接后形成编码视紫红质的成熟mRNA)。
2. 必背标注【精准背诵】
① 基因组分类:细胞核染色体基因组(编码约3万基因)+线粒体基因组(编码37个基因);
② 基因结构核心元件:外显子(编码区)、内含子(非编码区)、启动子/增强子(调控区);
③ 基因表达关键过程:DNA转录→前体mRNA剪接→成熟mRNA翻译→蛋白质。
3. 设备关联(超广角/OCT)
•超广角眼底相机:虽无法直接观测基因结构,但可通过“视网膜色素沉着、血管形态异常”等表型,初步提示遗传相关性眼底病(如视网膜色素变性的“骨细胞样色素”);
•OCT(光学相干断层扫描):可通过“视网膜感光细胞层变薄、RPE层结构异常”等影像特征,间接反映基因缺陷导致的细胞结构/功能异常(如Leber先天性黑朦的“外核层缺失”)。
(二)分子遗传学核心技术方法【精读记忆(细节)+设备关联】
遗传学技术是定位眼底病致病基因、解析遗传机制的工具,前2项为核心技术,需精准背诵;后2项为拓展技术,精读记忆即可。
1. 核心技术解读+必背标注+设备关联
(1)基因多态性与遗传标记
•核心解读:基因多态性是DNA区域中等位基因的变异形式,是定位致病基因的关键工具,主要类型包括:
◦限制性片段长度多态性(RFLP):DNA酶切位点的碱基变异导致酶切片段长度差异,是第一代遗传标记(曾用于RHO基因的定位);
◦短串联重复(STR):又称微卫星DNA,重复单元为1~6bp(如“CA”重复),是第二代遗传标记,已定位5000多个二核苷酸卫星至人类23条染色体(用于RPGR基因的连锁分析);
◦单核苷酸多态性(SNP):单个碱基的变异(如A→G),是第三代遗传标记,人类基因组中约有3百万个SNP,可通过芯片、高通量测序检测(用于年龄相关性黄斑变性(AMD)的易感基因关联分析)。
•必背标注【精准背诵】:遗传标记三代类型:RFLP(第一代)→STR(第二代)→SNP(第三代);
•设备关联:通过设备观测的“表型严重程度差异”(如不同RP患者的视野缩小范围),可辅助验证基因多态性的表型关联。
(2)遗传分析技术
•核心解读:用于定位眼底病致病基因、解析遗传机制的技术,主要包括:
◦连锁分析:利用“致病基因与遗传标记共分离”的原理,定位已知遗传方式的疾病基因(如通过连锁分析将RPE65基因定位于1p31);
◦关联分析:比较病例组与对照组的基因频率差异,定位复杂眼病(如AMD)的易感基因(如CFH基因的Y402H多态性与AMD关联);
◦基因突变检测技术:包括单链构象多态性(SSCP)、变性梯度凝胶电泳(DGGE)、DNA芯片、二代测序等,用于检测基因序列的碱基改变。
•必背标注【精准背诵】:核心遗传分析技术:连锁分析(定位单基因病)、关联分析(定位复杂病);
•设备关联:设备观测的“特征性影像表型”(如AMD的“玻璃膜疣”),可作为关联分析的“表型纳入标准”,提高基因-表型关联的准确性。
2. 次要技术解读+必背标注+设备关联
(1)基因克隆技术
•核心解读:获取眼底病致病基因的技术,主要包括:
◦定位候选克隆:先通过连锁分析确定致病基因的染色体区域,再筛选该区域内的基因(是目前最常用的克隆策略,如RDS基因的克隆);
◦功能克隆:基于基因功能克隆致病基因(如RHO基因的克隆)。
•必背标注【精读记忆】:常用克隆策略:定位候选克隆;
•设备关联:无直接设备关联,但其克隆的致病基因可解释设备观测到的表型(如RPE65基因突变与OCT观测的“外核层缺失”关联)。
(2)蛋白质组学技术
•核心解读:分析眼底组织蛋白质表达的技术,核心技术包括双向电泳(2-DE)分离蛋白质、质谱(MS)鉴定蛋白质;可用于明确疾病状态下的蛋白表达变化(如AMD患者黄斑区的补体蛋白表达异常)。
•必背标注【精读记忆】:核心技术:双向电泳+质谱;
•设备关联:蛋白质表达异常对应的“细胞结构改变”(如补体蛋白异常导致的RPE层损伤),可通过OCT观测到“RPE层反射信号不均”。
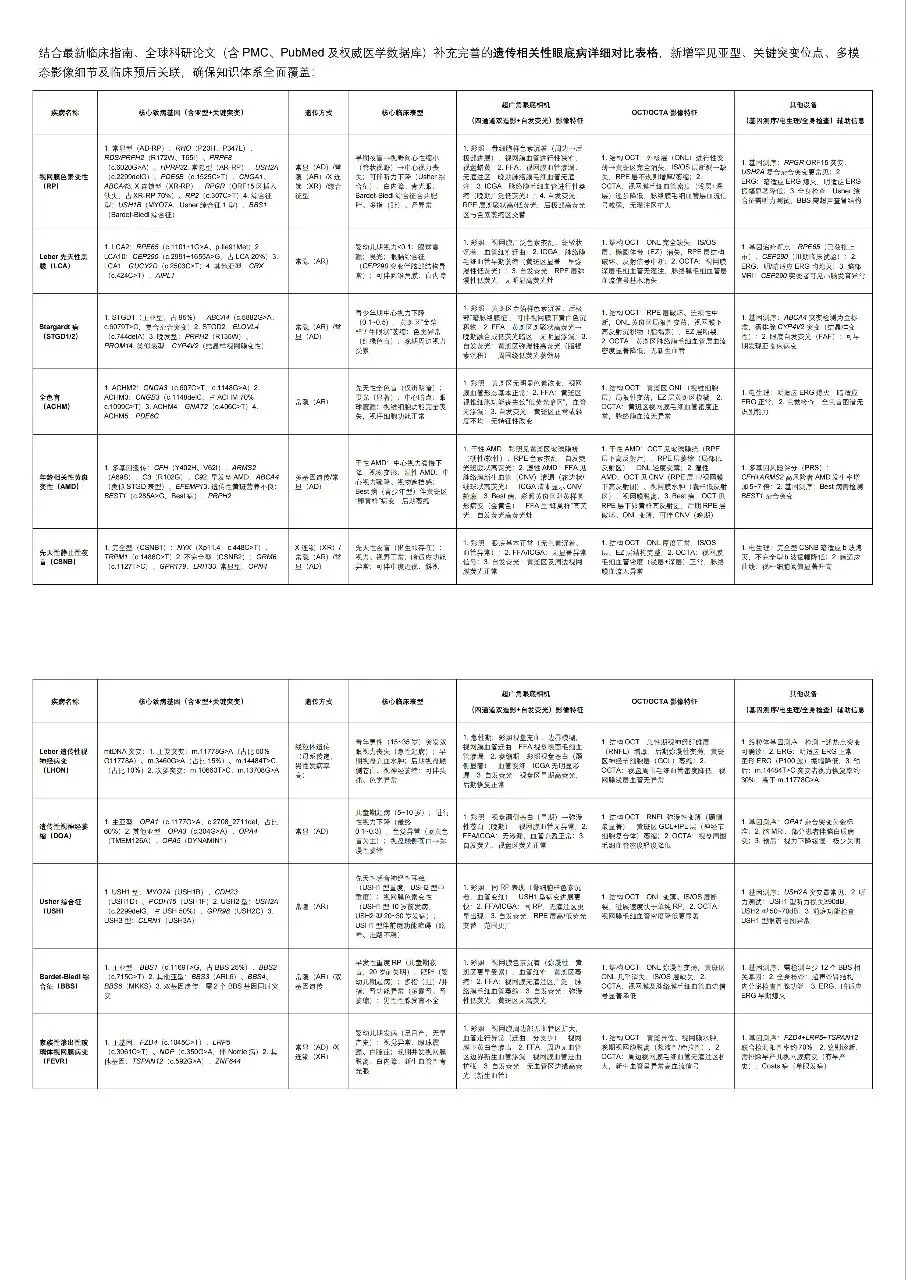
(三)常见眼底病的遗传特征【精准背诵+设备关联核心】
遗传特征是“基因-病理-表型”的核心纽带,所有疾病的遗传方式、致病基因、表型均需精准背诵,且为超广角/OCT的核心观测靶点。
1. 核心知识点解读+必背标注
(1)视网膜色素变性(RP)
•疾病特征:以视网膜感光细胞(视杆、视锥细胞)进行性变性为核心,早期表现为夜盲,逐渐进展为视野缩小、视力下降,晚期可失明;
•遗传方式:常染色体显性(AD)、常染色体隐性(AR)、X连锁隐性(XR)、散发型;
•关键致病基因:
◦RHO基因(1q41):编码视杆细胞视紫红质,P23H突变导致AD型RP;
◦RDS基因(6p21.1):编码视杆细胞盘膜边缘蛋白,突变导致AD/AR型RP;
◦RPGR基因(Xp11.2):X连锁RP的主要致病基因,男性患者病情严重。
•必背标注【精准背诵】:
◦遗传方式:AD/AR/XR/散发;
◦核心致病基因:RHO、RDS、RPGR;
◦核心表型:夜盲→视野缩小→失明。
(2)Leber先天性黑朦(LCA)
•疾病特征:婴幼儿期起病的严重遗传性视网膜病变,多数患者出生后即表现为严重视力损害(视力<0.1)、眼球震颤、畏光;
•遗传方式:主要为常染色体隐性遗传(AR);
•关键致病基因:
◦RPE65基因(1p31):编码RPE细胞视黄醇异构酶,突变导致RPE细胞无法合成视黄醛;
◦GUCY2D基因(17p13.1):编码视锥/视杆细胞鸟苷酸环化酶,突变导致感光细胞信号传导障碍。
•必背标注【精准背诵】:
◦遗传方式:AR;
◦核心致病基因:RPE65、GUCY2D;
◦核心表型:婴幼儿严重视力损害+眼球震颤+畏光。
(3)全色盲(Achromatopsia)
•疾病特征:视锥细胞功能完全丧失,表现为全色盲、畏光、中心暗点,视杆细胞功能正常;
•遗传方式:常染色体隐性遗传(AR);
•关键致病基因:
◦CNGA3基因(2q11.2):编码视锥细胞环核苷酸门控通道α亚基,突变导致通道功能异常;
◦CNGB3基因(8q21.1):编码视锥细胞环核苷酸门控通道β亚基,是全色盲最常见病因(约占25%)。
•必背标注【精准背诵】:
◦遗传方式:AR;
◦核心致病基因:CNGA3、CNGB3;
◦核心表型:全色盲+畏光+中心暗点。
(4)年龄相关性黄斑变性(AMD)
•疾病特征:中老年起病的黄斑区变性,分为干性(萎缩型)和湿性(新生血管型),表现为中心视力下降、视物变形;
•遗传方式:多基因遗传(遗传与环境共同作用);
•关键易感基因:
◦CFH基因(1q32):编码补体因子H,Y402H多态性增加AMD患病风险;
◦APOE基因(19q13.2):编码载脂蛋白E,ε4等位基因增加湿性AMD进展风险。
•必背标注【精准背诵】:
◦遗传方式:多基因遗传;
◦核心易感基因:CFH、APOE;
◦核心表型:中心视力下降+视物变形。
2. 设备关联(超广角/OCT+四通道双造影技术)
(1)视网膜色素变性(RP)
•超广角眼底相机(四通道双造影技术):可显示“骨细胞样色素沉着”及周边视网膜变性区,通过荧光素血管造影(FFA)观察视网膜血管狭窄,通过吲哚青绿血管造影(ICGA)观察脉络膜毛细血管萎缩范围;
•OCT:可检测视网膜外核层(感光细胞层)进行性变薄,早期发现结构异常。
(2)Leber先天性黑朦(LCA)
•超广角眼底相机(四通道双造影技术):可显示视网膜广泛色素沉着、血管细窄,ICGA观察脉络膜毛细血管早期萎缩;
•OCT:可检测视网膜外核层、光感受器内外节缺失,评估病变严重程度。
(3)全色盲(Achromatopsia)
•超广角眼底相机(四通道双造影技术):可显示黄斑区无明显色素改变,但FFA可观察黄斑区视锥细胞功能丧失导致的“暗区”;
•OCT:可检测黄斑区外核层(视锥细胞层)变薄,区分全色盲与其他黄斑病变。
(4)年龄相关性黄斑变性(AMD)
•超广角眼底相机(四通道双造影技术):采用“荧光素+吲哚青绿”双造影,同时显示湿性AMD的脉络膜新生血管(FFA显示渗漏)及脉络膜毛细血管萎缩(ICGA显示低荧光区),四通道技术提高造影分辨率与覆盖范围;
•OCT:可检测干性AMD的玻璃膜疣、RPE层萎缩,以及湿性AMD的脉络膜新生血管、视网膜水肿。
(四)眼底病遗传学的临床应用关联【精准背诵+设备应用核心】
本部分是知识点与工作应用的核心衔接点,需精准背诵“遗传机制-临床疾病-设备诊断特征”的对应关系,是使用超广角/OCT解读眼底影像的理论基础。
1. 必背标注【精准背诵】
① 精准诊断:基因检测+设备影像,明确遗传类型(如区分AD/AR/XR型RP);
② 靶向治疗:基于致病基因开发方案(如RPE65基因治疗LCA);
③ 预后评估:基因多态性+设备监测,预测疾病进展(如APOEε4携带者的AMD进展风险);
④ 遗传咨询:为患者及家属提供遗传风险评估(如XR型RP的遗传概率)。
2. 设备应用核心(超广角+OCT联合诊断逻辑)【精读记忆,需理解应用】
•RP:OCT识别“外核层进行性变薄”,超广角观察“骨细胞样色素分布范围”,联合判断病变进展;
•LCA:OCT识别“外核层/光感受器层缺失”,超广角观察“视网膜广泛色素沉着”,联合明确诊断;
•AMD:OCT识别“玻璃膜疣/RPE层萎缩/脉络膜新生血管”,超广角(四通道双造影)观察“脉络膜毛细血管萎缩/新生血管渗漏范围”,联合制定治疗方案;
•全色盲:OCT识别“黄斑区外核层变薄”,超广角观察“黄斑区暗区”,联合区分其他黄斑病变。
三、医生视角 必备拓展知识点(精读记忆,补充知识体系)
作为眼科设备工作者,需补充3个基础关联知识点,为后续学习铺垫:
1.遗传异质性:一种眼底病可由不同基因突变导致(如RP可由RHO、RDS等200多个基因的突变引起),设备观测的“表型差异”可辅助区分不同遗传亚型;
2.基因多效性:单个基因的突变影响多个器官/系统(如Marfan综合征同时导致晶状体脱位、骨骼畸形),设备需同时观测眼部及全身表型的关联;
3.四通道双造影技术原理:超广角眼底相机的四通道技术,可同时采集“眼底彩照、FFA、ICGA、自发荧光”四种影像,双造影(FFA+ICGA)同步显示视网膜-脉络膜的血管/结构异常,提高遗传相关性眼底病的诊断效率。
四、本节学习规划(落地执行,适配工作学习)
1.第一阶段(精准背诵):1天内完成“遗传概念、疾病遗传特征、临床应用”的精准背诵,同时联想OCT/超广角下的影像表现(如背诵RPE65基因突变时,同步记忆OCT的“外核层缺失”);
2.第二阶段(理解应用):结合超广角、OCT设备的实际影像,对照本笔记解读影像特征(如找到AMD的OCT影像,识别“RPE层萎缩”与CFH基因的关联);
3.第三阶段(拓展补充):阅读文献拓展“遗传知识点”(如OCT在基因治疗后的疗效评估),为后续设备操作做铺垫;
4.复盘巩固:每天用10分钟回顾本章节核心,结合工作中接触的眼底病例,随时联想遗传机制的相关知识,做到“见影像,想机制”。