国内细胞治疗产品已上市7款,但¥100万-129万元的售价导致其在国内营销惨淡,大家都意识到这不是一个适合中国国情的产品。加之基于LNP平台mRNA疫苗技术的发展,基因治疗技术的逐渐成熟,业界开始转向in-vivo细胞技术。in-vivo细胞疗法抛弃体外改造、培养、再回输的制造流程,直接向患者体内注射载体,使细胞制品直接在体内生成、扩增并发挥效应功能,节约大量生产成本,将会是一个可在中国特殊医疗体系内持续发展的潜在路径。体内细胞疗法技术平台主要使用LNP与病毒载体平台,本文介绍LNP技术。LNP技术的发展历经60余年,以脂质体的发现为基础,随后又发展了效率更高的阳离子脂质,最终形成基于可离子化脂质的现代LNP平台。FDA已批准上市的三款LNP药物,Alnylam制药公司的siRNA药物Patisiran(Onpattro®),两款COVID-19 mRNA疫苗,Pfizer-BioNTech的Tozinameran(Comirnaty®)和Moderna公司的Elasomeran(Spikevax®),构成了现代LNP药物的标准配方,即可离子化的阳离子脂质、磷脂、胆固醇、PEG化脂质四种核心脂质组分。这些组分通过优化LNP的稳定性、细胞摄取、核酸封装和内体逃逸能力,使其成为mRNA疫苗和基因治疗的关键技术。三款LNP药物使用的脂质,其结构与配方见下图。所使用的3个可电离脂质都含叔胺基团,pKa值6.0-6.7之间,其中两款mRNA疫苗产品的可电离脂质采用可生物降解设计;3种PEG化脂质则为 14 碳基长度的二烷基链,这对于它们进入体内后能迅速从LNP表面解离至关重要。
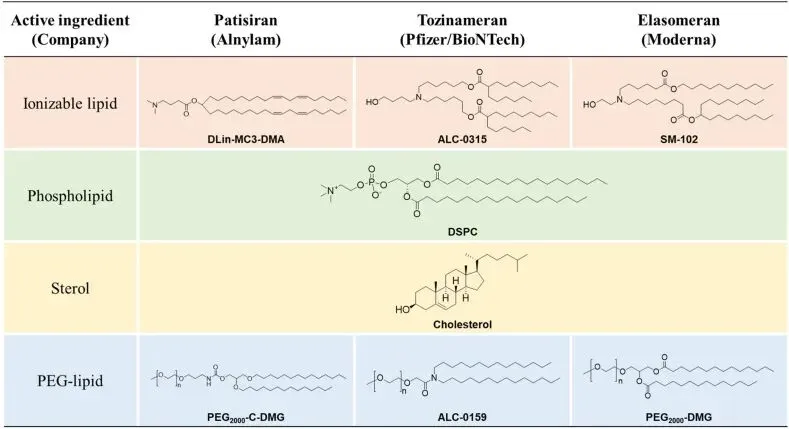
图2.LNP药物的脂质结构
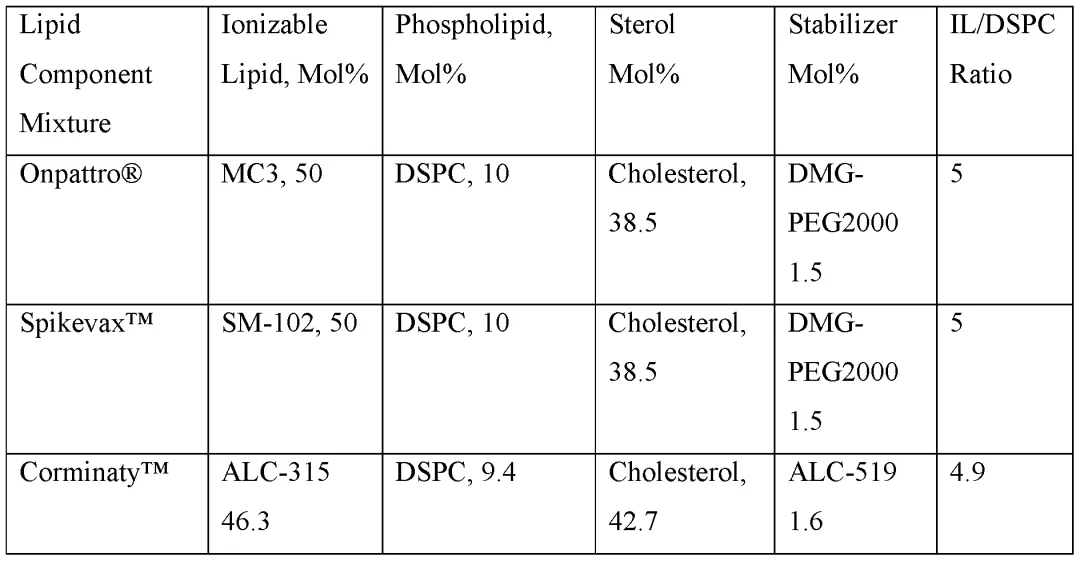
图3.LNP药物的脂质配方
1. 可电离脂质
可离子化脂质是LNP中最关键的组分,决定了LNP的效力和转染效率。
2. 磷脂
磷脂通常被称为‘辅助脂质’之一,负责构建LNP的结构和膜整合功能。
3. 胆固醇
胆固醇也是LNP必不可少的辅助脂质,通过调节膜的物理特性来提高LNP的整体性能。
4. 聚乙二醇化脂质(或称PEG-脂质)
PEG化脂质在LNP中通常摩尔比例最小,但对LNP的稳定性和体内行为具有决定性影响。
二
LNP制造方法
LNP的合成方法,或者更广泛地说,所有基于脂质的纳米颗粒的制造方法可以归为两类:
图4.LNP合成和制造的现有方法
LNP的成功研发依赖于多种因素的结合,包括合适脂质的选择,它们的比例和浓度。但是,制剂过程本身也同样重要,它直接影响纳米颗粒的关键质量属性(CQA),例如粒径、多分散指数(PDI)、封装效率、产率和形态。反之,这些CQA又在决定药品的药代动力学、细胞摄取、毒性和总体疗效方面起关键作用。
图5.制剂方法对LNP终产品CQA和特性的影响
1. LNP合成的自上而下方法
自上而下法通常是高能方法,其原理是将脂质置于高温、高压的恶劣条件下,产生高剪切应力,从而实现LNP尺寸的减小。 这些方法既可以单独制备纳米颗粒,也可以与另一种方法结合,以提纯和提高纳米颗粒的质量。一种典型的组合是将薄膜水合法与挤出机一起使用。
总体而言,这些方法的优势在于大规模应用。然而,系统中涉及的高能量可能导致脂质或核酸发生改变,因此不适用于生物领域的可持续应用。另外,它们的封装效率较低,且在小体积制剂(<毫升)方面存在困难。
高压均质法(HPH)
高压均质法利用高速搅拌器制备熔化脂质、水和表面活性剂组成的乳剂。溶液在高压条件下通过小孔被高速推送。液体获得的高速会伴随湍流、高剪切力和窜货现象,使得即使在高浓度下也能形成有机纳米颗粒。
HPH合成LNP有两种主要方法:热均质法和冷均质法。
超声均质法
LNP也可通过超声来制备,采用些方法时,超声波会产生空化现象,导致气泡的形成和破裂,从而合成LNP。此外,引入的能量有助于破碎纳米颗粒,实现尺寸减小。尽管这种方法能够控制尺寸,但它的封装率很低,还可能导致脂质降解和金属污染。
2. LNP的自下而上方法
自下而上的方法侧重于从纳米颗粒的基本成分(如脂质或聚合物)开始,将它们组装成最终的纳米颗粒产品。这种方法包括多种技术,如薄膜水合作用或各种纳米沉淀/自组装方法。
薄膜水合
薄膜水合法,又称Bangham法,是用于LNP和脂质体制备的经典技术。将脂质溶解在有机溶剂(如乙醇和氯仿)中,通过蒸发去除有机溶剂形成脂质薄膜,然后用水溶液对其进行水合以引发纳米颗粒的形成。
薄膜水合法可制备实验室规模的LNP,且残留溶剂少、生产流程简单、成本低。
然而,由于对其合成/混合的条件控制不佳,所制备LNP的理化性质很差,批间重复性极低,样品尺寸分散度极高,且几乎无法控制尺寸,由于这些原因,薄膜水合法通常会与高能技术相结合,如通过挤压或超声处理来减小纳米颗粒的尺寸并使其均质化,提高对所制备纳米颗粒的控制水平。
当生产量增加时,有溶剂的用量也会增加,蒸发有机溶剂耗时较长,此外还存在封装效率低和规模化生产困难的局限性。
基于纳米沉淀的LNP合成方法
基于自组装或称纳米沉淀的方法是开发新冠疫苗相关LNP的主要方法。其基本原理是将含有待封装的亲水性原料药或寡核苷酸的水相,与含有脂质的水混性溶剂(如乙醇)混合。
当溶剂与水相混合时,其局部浓度的降低会导致脂质溶解度下降,进而触发脂质的自组装并生长形成纳米颗粒。
图6.混合时间对LNP粒径的影响
自组装过程分为4个步骤:过饱和,成核,生长,稳定或成熟。所制备的LNP,其理化特性很大程度上取决于合成条件。
最重要的因素有:
混合时间对生成的LNP尺寸有显著影响;混合速度越快,合成的LNP尺寸越小;
使用高浓度的表面活性剂或其他两亲性稳定剂,形成的纳米颗粒会减小其最终尺寸;
溶质浓度越高,形成的晶核数量就越多,从而增加聚集事件的发生,最终导致纳米颗粒的最终尺寸增大;
黏度和温度在决定纳米颗粒的最终尺寸方面发挥作用,但其影响更难准确地预测和测量。
基于溶剂的方法,主要局限性在于溶剂可能残留在最终溶液。不过,监管框架对乙醇含量来说相对灵活,FDA允许的乙醇含量高达0.5%,剩余的过量溶剂可以通过离心、切向流过滤、透析等方法轻松去除。此外,后处理纯化步骤也确保了最终药品具有更好的稳定性。
i. 移液混合法
移液混合法是一种快速的制剂技术,适用于小批量LNP。将含有脂质的有机溶液与含有核酸的缓冲液混合,通过移液操作快速混匀,使用多通道移液可以实现高通量的LNP制备。
这种方法的优点包括操作简单和时间效率高。然而,该技术存在重复性差和可扩展性低的局限性,所制备的LNP多分散性强,胶体稳定性差,核酸封装效率低。
ii. 涡旋
与移液混合相比,涡旋混合可以快速制备小规模批次的LNPs,且减少了人工投入。在这种方法中,将缓冲溶液与脂质乙醇溶液混合,然后在涡旋混合器上以中等速度涡旋。
这种方法在实验室规模下易于实施和操作,通常用于实验室规模的体积(100ul-4ml)。其局限性与移液混合法相似
iii. 乙醇注入法
乙醇注入是一种LNPs制备的常用技术,是薄膜水合法最早的替代方法之一,无需超声处理,由Batzri和Korn于1973年首次提出并开发。将脂质溶解在乙醇中,在搅拌的同时快速注入含有待封装核酸的水性溶液中,由于混合溶剂极性的增加,注入的脂质溶液会被水性缓冲液迅速稀释,从而快速形成囊泡。
相比传统方法,错流注入法是为大规模生产而开发,在这种方法中,乙醇溶液通过一个带有错流管的装置注入缓冲液中,从而形成脂质体。
乙醇注入法形成的LNPs的大小受脂质浓度、搅拌速率、注入速率以及所用脂质的影响。然而,其缺点是重复性差、可扩展性低及封装效率低,此外,超声处理过程可能降解脂质和药物成分,该方法未被广泛使用,
iv. 超临界液体法(SCFs)
SCFs法的开发旨在减少纳米沉淀过程中溶剂的使用。有多种方法可供选择,最常用的是超临界反溶剂法(SAS),即超临界液体通过加压室,同时药物通过喷嘴喷洒在超临界液体上,当水与溶剂水合时会生成LNP。超临界二氧化碳与有机溶剂互溶,并作为溶质的反溶剂发挥作用。
实际应用中这些方法存在重大缺陷:首先,它们只能处理可溶于超临界二氧化碳的物质,限制了应用;另外,这些方法涉及的高温高压会对原料药带来风险;再者,这些方法需要极高的投资成本和能源消耗,难以大规模实施;最后,由于其复杂性,这些方案尚未商业化。
v. T型接头混合法
Hirota等于1999年提出了通过T型接头混合制备的脂质基药物,与涡旋和移液等宏观混合方法相比,T型接头混合能制备出可重复且可控的载核酸脂质复合物,是商业化生产大批量mRNA-LNP的常用选择。
T型接头通过注入两种不同的溶剂,使各入口处的溶剂相互碰撞产生湍流,从而实现快速混合。有研发表明,通过T型接头混合对流速的控制会影响纳米颗粒配方的特性。
与传统的脂质体方法相比,该方法通常具有更高的封装效率,然而,T型接头快速混合所需的高流速在实验室规模中并不适用,更适合大规模生产。
vi. 冲击射流混合器(IJM)
IJM的核心是通过高压驱动的流体撞击实现脂质相与水相的快速、均匀混合,通过调控流体压力、流速、射流角度等混合参数,可精确控制LNPs的粒径、分散性和核酸封装效率,满足不同应用场景的需求。
IJM具有显著优势,可在毫秒级时间内实现液体均匀混合,制备的LNPs粒径分布窄,批次间重复性高,可通过放大流体能量实现大规模生产,尤其适合工业级需求,新冠疫苗期间,包括Pfizer在内的多家公司将IJM用于疫苗生产。
vii. 微流控合成LNP
精确控制混合参数对获得均匀的LNP群体和良好的批间重复性至关重要,因此微流控技术迅速成为合成LNP的理解解决方案。
微流控技术是一种通过微通道操控小至nL级别小体积液体的技术。在微米尺度下,液体的行为与日常不同,呈现层流状态,使得在整个合成过程中都能够精确控制液体的流动行为,并能提高体积/表面积比。此外,微流控技术能够处理极小体积的制剂,这对经济高效的筛选至关重要,使其成为RNA-LNP药物产品早期开发阶段的理想选择。
在这种尺度下,由于液体流动的层流性,溶剂和水相的混合过程引发纳米粒子的自组装,其主要优点是可控性和可重复性极佳。
常用的微流控混合方法有扩散法(如流动聚集)、混沌法(人字形或挡板混合器),都能提供可控流速、效率、重复性和封装效率,被认为是最先进的LNPs制备方法。
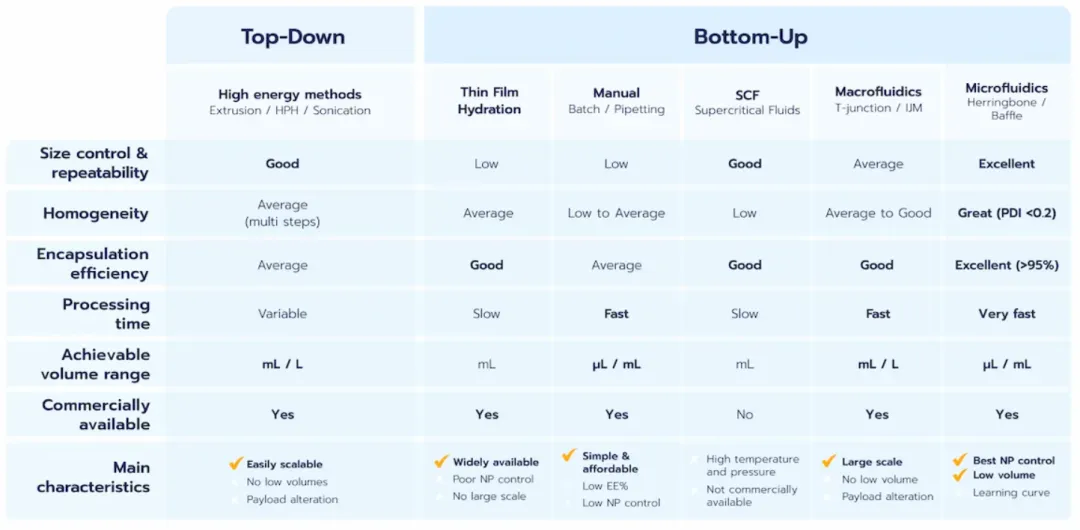
图7.LNP制造工艺对比表
三
LNP应用
mRNA-LNPs技术具有快速、灵活、高效且安全的特点,在多种疾病方面展现出巨大潜力,尤其是在流行性传染病快速响应上具有重要意义。然而,‘标准’LNPs的特性会自然吸附血液中的ApoE蛋白,导致LNPs像乳糜颗粒一样被肝脏的LDL受体捕捉吸收。
为拓展LNP技术的应用范围,如in-vivo CAR-T制备,需要实现LNPs可控的靶向递送。目前的研究主要使用3种调节手段重新定向LNPs:被动靶向、主动靶向与内源性靶向。
1. 被动靶向
被动靶向利用靶组织独特的解剖和生理特征来设计适合它们的LNPs,包括改变LNPs的粒径、电荷或形状,优化其在特定组织中的积累。例如,纳米颗粒在肿瘤组织中的累积依赖于肿瘤血管的渗透性,即渗透与滞留效应,肿瘤血管比正常血管通透性更高,允许特定大小的纳米颗粒穿过内皮细胞之间的间隙,从而在肿瘤组织中累积。
2. 主动靶向
主动靶向是指通过连接靶向配体,如抗体、抗体片段、肽、配体等,来修饰LNP的表面,这些配体与靶细胞上的特定受体结合,促进受体介导的细胞摄取。
例如最新的研究中使用双特异性抗体,而非将抗体化学键合到LNP上。抗体的一端结合LNP表面的PEG,另一端结合靶细胞上的目标分子,如T细胞的CD5分子或内皮细胞的PECAM-1。这种方法能够使用现货型LNPs,并根据靶标的不同,简单地与不同的双特异性抗体混合。
3. 内源性靶向
内源性靶向是指改变LNP的化学组成,使其能够到达体内特定组织。通过在LNP结构中添加额外的脂质成分或使用新型脂质来实现这一目标,一旦注入血液,这些改变会导致某些蛋白附着在纳米颗粒上,形成保护层,这一保护层引导纳米颗粒到达肝脏以外的特定组织,如骨髓、脾脏或肺部。
较流行的方法是,向LNPs的4种脂质配方中添加第5种选择性器官靶向(SORT)脂质,如添加一个永久带正电的脂质(如DOTAP)使LNPs特异性地递送至肺部,或添加永久带负电的SORT脂质(18PA)将其引导至脾脏。
此外,另一种已被证实能将纳米颗粒导向脾脏的策略是使用短尾脂质,有研究表明,mRNA表达会随着可电离脂质尾部长度的改变逐渐从肝脏转移到脾脏。
最新研究表明,层状脂质纳米颗粒(LLNPs)采用聚阴离子涂层(例如某些多糖或丙烯酸聚合物)代替PEG,这些涂层展现出显著的‘隐蔽’特性,使脂质纳米颗粒能够绕过肝脏,到达骨髓或肿瘤部位。
参考资料:
Lipid nanoparticles: Composition, formulation, and application; doi: 10.1016/j.omtm.2025.101463
Lipid nanoparticles for delivery of RNA therapeutics: Current status and the role of in vivo imaging; doi: 10.7150/thno.77259
Introduction to lipid nanoparticle manufacturing and LNP synthesis- Inside Therapeutics; https://insidetx.com/resources/reviews/lnp-synthesis-overview-of-the-manufacturing-methods/
Fundamentals of lipid nanoparticles formation mechanism by nanoprecipitation - Inside Therapeutics; https://insidetx.com/resources/reviews/fundamentals-of-lipid-nanoparticles-formation-mechanism/
The Role of Four Lipid Components of LNPs; https://www.biochempeg.com/article/362.html
Passive, active and endogenous organ-targeted lipid and polymer nanoparticles for delivery of genetic drugs; doi: 10.1038/s41578-022-00529-7
Development of mRNA Lipid Nanoparticles: Targeting and Therapeutic Aspects; doi: 10.3390/ijms251810166
https://gemini.google.com/
ps:这篇文章写作时参考了大量文献,整理起来有点乱,花费时间远超预期,让我有些难受,本来应该很快把iv-vivo这个系列完成,再添加些软件类推广,看来要延后了。原计划要补充的LNP免疫原性以及质量参数部分,暂时就不写了,看看有时间了再补。
另外,查阅资料时还用到了AI工具,虽然信息获取方便了许多,但也有信息不全以及信息不准确的忧虑,从而又陷入反反复复查询验证的泥潭。更令人受挫的是,发现AI的资料整理能力与表达能力比我更好,看AI汇总信息时再看看自己写的,顿时就不好了。
总而言之,这篇关于LNP的长文算是完成了,读完后基本能对LNP有个大致的了解,更深入的探索还是要依赖于文献的阅读。
在AI辅助的时代,还是不能丢失自己的判断,个人关键技能要勤学勤练,共勉!