想跟大家说,我们的经验性抗生素治疗到底出现什么问题。
先从两个病例开始:第一个是男的 58 岁,有高血压、糖尿病,症状是发热、咳嗽咳痰、右上腹疼痛,诊断是肺炎和肝脓肿,合并感染性休克、急性肾功能衰竭,然后显然下面的问题是抗生素怎么用,先不着急说。第二个是女的 67 岁,有高血压、冠心病、慢性肾病(CKD),发热、咳嗽咳痰八天,呼吸困难两天,用头孢曲松五天治疗无效,还合并感染休克,那抗生素怎么改?
我相信谈到这儿的时候,其实这样的病例我们天天都会碰到。我相信有的老师会说,这么重症的感染,我的经验性抗生素应该覆盖耐药的阳性球、耐药的阴性杆和真菌,所以就在阳性球这一列选一个,阴性杆这一列选一个,再把真菌选一个 —— 不用想,这是错的。所以像泰能、万古、大扶康、美平、斯沃、科赛斯这些药,今天似乎就要跟大家说,这样的想法是完全错了。
这样的想法是怎么来的呢?早在 20 年前,阿根廷的呼吸科大夫露娜就跟我们说,如果是院内肺炎、呼吸相关性肺炎,只有早期的充分的抗生素治疗,病人的病死率才是降低的。过了 10 年,2006 年,一个叫库玛的加拿大人说,这个时间是要争分夺秒的,你每延误一小时,病人死亡的机会就会明显增加。相信我,这样的说法是‘too good to be true’,回去查一查‘too good to be true’是什么意思。
那回过头来呢,我们说指南。我们知道这是上一版的指南,这一版指南也一样说:对于重症感染,你应该联合应用抗生素、用超广谱的,去覆盖所有可能的病原微生物,这样才能有效地降低病死率。我们说这样一个想法,是建立在这么一堆假设基础上:如果病人是重症感染,他死亡的机会多,这是毫无疑问;但如果病人是重症感染,我们经验性抗生素就应该覆盖所有可能的病原微生物,包括多重耐药的病原微生物 —— 那这样的话就要求我们用广谱抗生素,甚至联合治疗。我们今天试图跟大家说,这样的逻辑是完全、完全、完全错误的,重要的事说三遍。
第一个错误的概念就是:重症感染是耐药细菌引起来的。这在某些时候答案是 yes,我相信这样的耐药细菌,无论是 ICU 的老师还是其他科室的老师都见过,比如国内的数据、国外的数据都显示,像产超广谱 β- 内酰胺酶(ESBLs)的细菌是全球流行的,中国也不例外;还有产碳青霉烯酶的不动杆菌,我相信大家也都知道,即便是检测结果显示敏感的,多半也不是真的敏感,只是没检测出来,仅此而已。
但是蛮有意思的是,稍微清晰一点的研究告诉我们,刚才刘老师也提到了,其实耐药菌和细菌的毒力并不是一回事。这是美国的研究:找了社区获得性的耐甲氧西林金黄色葡萄球菌(MRSA)和医院获得性的 MRSA,去看它们的药敏,会发现浅颜色的社区获得性 MRSA 其实对更多的抗生素更敏感;但蛮有意思的是,当检测毒力因子时,会发现 3/4 的社区获得性 MRSA(更敏感的菌)是有毒力因子的,而对照组更耐药的 MRSA 只有 5%,统计学差异非常显著。所以这样的基础研究其实告诉我们,毒力和耐药是完全不一样的概念,不能混为一谈。
我到现在为止看到的内科感染里,很重的是猪链球菌感染的病人,我们会看到两种不同的临床表现:一种是化脓性脑膜炎,一种是中毒性休克综合征,中毒性休克综合征的病死率在 60% 以上,病人可能从急诊科送到感染科,50 米的路上就死了。但是蛮有意思的是,这些猪链球菌对青霉素都敏感,没有一例是耐药的。所以我想说的是:重症感染其实只是说它影响到了器官功能、危及到病人的生命,和细菌耐药不耐药是没有任何关系的。所以看到重症感染的病人就一定要覆盖耐药菌的概念,是完全错误的。
第二个错误概念:早期的正确的经验性抗生素是能降低病死率的。这是这些年大家听‘枪手们’在台上讲的很普遍的一个概念,这概念是对的吗?蛮有意思的是,《柳叶刀》杂志几年前发表的文章,在外科 ICU 做了 2 年前后对照:第 1 年是所谓积极的抗生素治疗,就是只要怀疑是感染,留了培养之后就用广谱抗生素,等到证实不是感染再停掉;第 2 年是保守的抗生素治疗策略,等到微生物学的检查证明是感染之后再把抗生素用上。很好玩的是,第一个阶段抗生素用得早,第二个阶段更迟,延误的时间大概在半天到一天之间。但很有意思的是,如果看病死率,会发现第一个阶段的病死率是更高的,而延误用抗生素的第二阶段,病人的病死率反而更低。所以这样的研究告诉我们,对于可疑的外科 ICU 获得性感染,等待客观的资料回来之后再开始抗生素治疗,其实并不一定增加病死率。
第三个错误概念:我们认为广谱抗生素其实更有效。我如果选了一个广谱的,或许窄谱也行,但选广谱总不会差吧?这是好多老师自己的想法,我们试图告诉大家,这个概念恐怕也是错的。什么叫广谱呢?维基百科(它的创始人现在还在厄瓜多尔大使馆里)说,广谱抗生素一般对多种致病微生物有效,比如阳性球菌、阴性杆菌,包括厌氧菌;而窄谱抗生素相对应用范围更窄,针对的敏感细菌更少。所以广谱抗生素通常用作经验性治疗,窄谱抗生素通常用作针对性治疗。
那什么叫好的抗生素治疗呢?首先得定义‘好’:我们把‘好’分为两种概念,一个是‘充分’,就是只要抗菌谱是 ok 的,就是充分的;还有一个是‘恰当’,就是不仅抗菌谱得好,疗效还得好,用上去之后病人能活,病死率能下降。如果从这个角度看,广谱抗生素到底是不是充分的、恰当的抗生素治疗呢?有的时候是,比如针对耐药细菌时;但有的时候,广谱抗生素可能是充分但不恰当。比如有敏感的金黄色葡萄球菌菌血症的病人,足够多的资料告诉我们,对于这样的阳性球菌,万古霉素比青霉素更广谱,无论敏感还是耐药,万古霉素理论上都管用,但很有意思的是,用到临床上,更广谱的万古霉素其实病死率是增加的,治疗失败率是升高的。这是典型例子,告诉我们广谱抗生素虽然抗菌谱 ok,但用上去并不好。
还有没有证据说明广谱抗生素既不充分又不恰当呢?有,德国人做的研究:找了一堆重症感染的病人,甚至有部分合并感染休克,随机分成两组,一组单用美罗培南,一组是美罗培南加莫西沙星。蛮有意思的是,一半的病人是社区感染,40% 的病人是肺炎,所以这里面一定会有刚才刘老师说到的社区获得性肺炎的病人。对于社区获得性肺炎,美罗培南和莫西沙星谁更广谱?很多老师会说当然美罗培南更广谱,但很有意思的是,针对社区获得性肺炎,更广谱的美罗培南其实是错误的,这毫无疑问 —— 它增强的阴性杆菌覆盖是没用的,对耐药阳性球菌的作用和罗红霉素是等效的,而且它最大的问题是不能覆盖非典型病原体(比如支原体、衣原体),刚才刘老师已经提过了。而我们有足够多的证据说明,对重症的社区获得性肺炎,如果不覆盖非典型病原体,病人的病死率是增加的。所以这告诉我们,广谱抗生素并不是什么时候都‘保险’,不能说我用了广谱抗生素就一定比窄谱好。
还有一个问题:是不是应该联合应用抗生素,就一定比单药好?早年间法国人说,对于呼吸机相关性肺炎,确实得联合用泰能、万古和阿米卡星,才能覆盖 90% 以上的病原微生物。但真的是这样吗?还是刚才那个德国人的研究,600 个重症感染的病人,单药和联合用药的比较,比较的是器官功能衰竭的情况有没有变化(先不看病死率)。我知道这图小一点,但我也不告诉大家哪个点是哪组,你们看得出差别吗?看不出差别。所以这样的研究告诉我们,没有研究证明联合用药是真的有效,病死率也没有任何差别。2014 年的研究也告诉我们,和单药治疗相比,对于重症感染,联合用药不能改善病死率,也不能降低治疗失败率。
还有的老师说,指南里都告诉我们,经验性抗生素应该覆盖所有可能的病原微生物,所以我对这个病人就应该考虑阴性杆菌、阳性球菌、厌氧菌、真菌等等。我的想法是:别看指南里写的,指南里这一条是百分之百错误的。为什么?如果我们现在有一个重症感染的病人,用什么抗生素呢?第一个要覆盖阴性菌,我们知道碳青霉烯类是覆盖阴性菌中覆盖率比较好的,所以用一个碳青霉烯类;但有碳青霉烯类耐药的阴性杆菌吗?肯定有,比如老师会说嗜麦芽窄食单胞菌,我们医院的嗜麦芽窄食单胞菌全都是天然耐药的,所以为了覆盖它,还得再加一个药,比如我们家一线药是复方新诺明;那有没有对这俩药都耐药的呢?肯定有老师会说,我们家现在的不动杆菌对这俩药都没用;假设舒巴坦对不动杆菌是好的,那我们把舒巴坦加上,还有耐药的吗?当然有,比如产碳青霉烯酶的肠杆菌科细菌(CRE),对什么都耐药怎么办?得用多粘菌素 B,这就四个药了,还没说有新德里金属 β- 内酰胺酶(NDM)的阴性杆菌。
再看阳性球菌:万古霉素很广谱,适应症也广,选它没问题;但有万古霉素耐药的吗?一定有,比如万古霉素耐药肠球菌(VRE),虽然国内整体比例不高,但不是一两例,所以至少还得再加一个药针对 VRE,这就六个药了。厌氧菌我们暂时不说,假装打阴性杆菌的药能盖住;真菌呢?一个药绝对不可能覆盖所有真菌,至少得俩;病毒呢?至少得用奥司他韦覆盖流感病毒,再用更昔洛韦覆盖疱疹病毒,就当别的病毒没药可治,至少俩抗病毒药;结核呢?如果要考虑结核,至少得加五个药。还有别的没说完的呢!所以如果让你同时用 15 种抗菌药和抗病毒药,你能覆盖所有的病原微生物吗?绝无可能!
所以即便各位老师想让经验性抗生素覆盖阴性杆菌、阳性球菌和真菌,也只是覆盖了一部分病原微生物。对临床医生来讲,最重要的是:无论你怎么用经验性抗生素,一定是覆盖了一部分病原微生物,而漏掉了另外一部分。问题在于医生的水平差异 —— 你凭什么覆盖这部分、扔掉其他部分?是不是从1床到 100 床全是覆盖同样几种?如果是那样,我让等会儿倒水的姑娘开抗生素就行了,没必要要医生,因为你对每个人的治疗方案都一样。所以其实我们要跟大家说的是:经验性抗生素不能覆盖所有可能的病原微生物,它应该覆盖的是‘最可能’的病原微生物。所以一床和二床、二床和三床的方案其实是不一样的,你对不同的病人,要根据他的特点,判断应该覆盖哪几种、扔掉哪几种,应该是这样。
那回过头来,还有‘降阶梯治疗’,有证据说明它是有效的吗?韩国人的文章:对医院获得性肺炎随机分成两组,一组是降阶梯治疗,一开始用泰能加万古(对医院获得性肺炎这样的组合没问题),等到有确切结果结合疗效再降阶梯;第二组是不降阶梯治疗,第一个抗生素按指南选(不包括泰能和万古),就一直用。我们看这两组:降阶梯组因为用了泰能和万古,经验性抗生素的正确率是 80%,对照组只有 50%;但蛮有意思的是,住院病死率没有差异,而且降阶梯组在治疗过程中,38% 的病人出现多重耐药病原微生物,对照组只有 17%,统计学差异非常显著。所以这样的研究告诉我们,所谓早期广谱抗生素、最后再降阶梯的策略其实没用,不能改善病人的死亡风险,反而增加耐药细菌感染和定植的机会。
无独有偶,法国人也做了研究:找了 120 个病人,分成降阶梯和非降阶梯治疗,结果发现两组病人 ICU 住院日一样,降阶梯组抗生素疗程反而延长一天半(统计学有显著差异);和刚才的研究一样,降阶梯治疗组需要治疗的二重感染比例明显增加。其实大家想一想降阶梯治疗提出的历史,都知道是厂家推动、有国内外专家背书的策略。但降阶梯的重点不在于‘降’—— 你要不‘爬上去’,怎么‘降’?一开始在‘地下三层’,往哪降啊?所以它强调的重点仍然是早期的‘重锤猛击’,仍然是对阴性菌、阳性菌、厌氧菌、真菌进行‘全覆盖、大包围’,这是很愚蠢的错误。
为什么我好像把这些年大家认为正确的理念说得一钱不值?因为我要说的是:我们诊断感染真的很容易吗?有的时候很容易,比如豆腐上长的毛霉菌,不用显微镜、不用生化检查,我就能诊断;但问题是临床上能这么诊断的太少了。那临床医生怎么诊断感染呢?很多老师说‘发烧加白细胞升高,就考虑感染’,没错,但很有意思的是,住院病人中‘发烧加白细胞升高’的,有 3/4 都不是感染!所以按‘发烧加白细胞升高’诊断感染,准确性只有 20%。
10 年前加拿大人做了一篇文章,编了三个病例:三个病例共同特点是体温都是 38.5℃,白细胞都是 18000/μL,只是严重程度不一样 —— 第二个病例比第一个多了休克,第三个病例有多器官功能衰竭,病情越来越重。然后问医生‘你觉得这人是感染吗’,结果发现病情越重,认为是感染的医生比例越高,用广谱抗生素经验性治疗的比例越高,不敢不用、不敢停抗生素的比例越少;甚至随着病情加重,大家用抗真菌药的欲望越强,跟中国人一样,加拿大医生也这样。但为什么病情重就一定是感染?我如果出门被车撞了,照样可以休克、器官衰竭,跟感染有什么关系?一点关系都没有!所以‘病情重就一定是感染、一定是耐药菌感染’的概念,是要扔掉的。
按照这样的想法诊断感染,准确性是 54%—— 什么意思?比如济宁市第一人民医院 ICU 谢主任有个病人,让我去会诊判断是不是感染,我跑过去花两小时看完,给个诊断,这准确性和‘拿钢镚儿抛,正面是感染、反面不是感染’是一样的,50% 左右,别乐,就是这意思。所以别以为你判断的感染就一定是感染。
即便看指南,也有证据说明:按指南诊断耐药细菌感染,或者区分耐药菌是感染还是定植,敏感性虽然高,但特异性极差,最高不超过 40%。所以回过头来说,刚才《柳叶刀》那篇外科 ICU 的研究,为什么积极用抗生素病死率反而高?作者自己在讨论里写:或许在最初两天到三天内,对没有感染的病人用无效的抗生素,带来的风险超过了获益 —— 比如现在大家感兴趣的肠道菌群紊乱等等。而且有足够多的证据说明,对没有感染的病人长时间用抗生素,其实伴随着病死率增加,而不是降低。
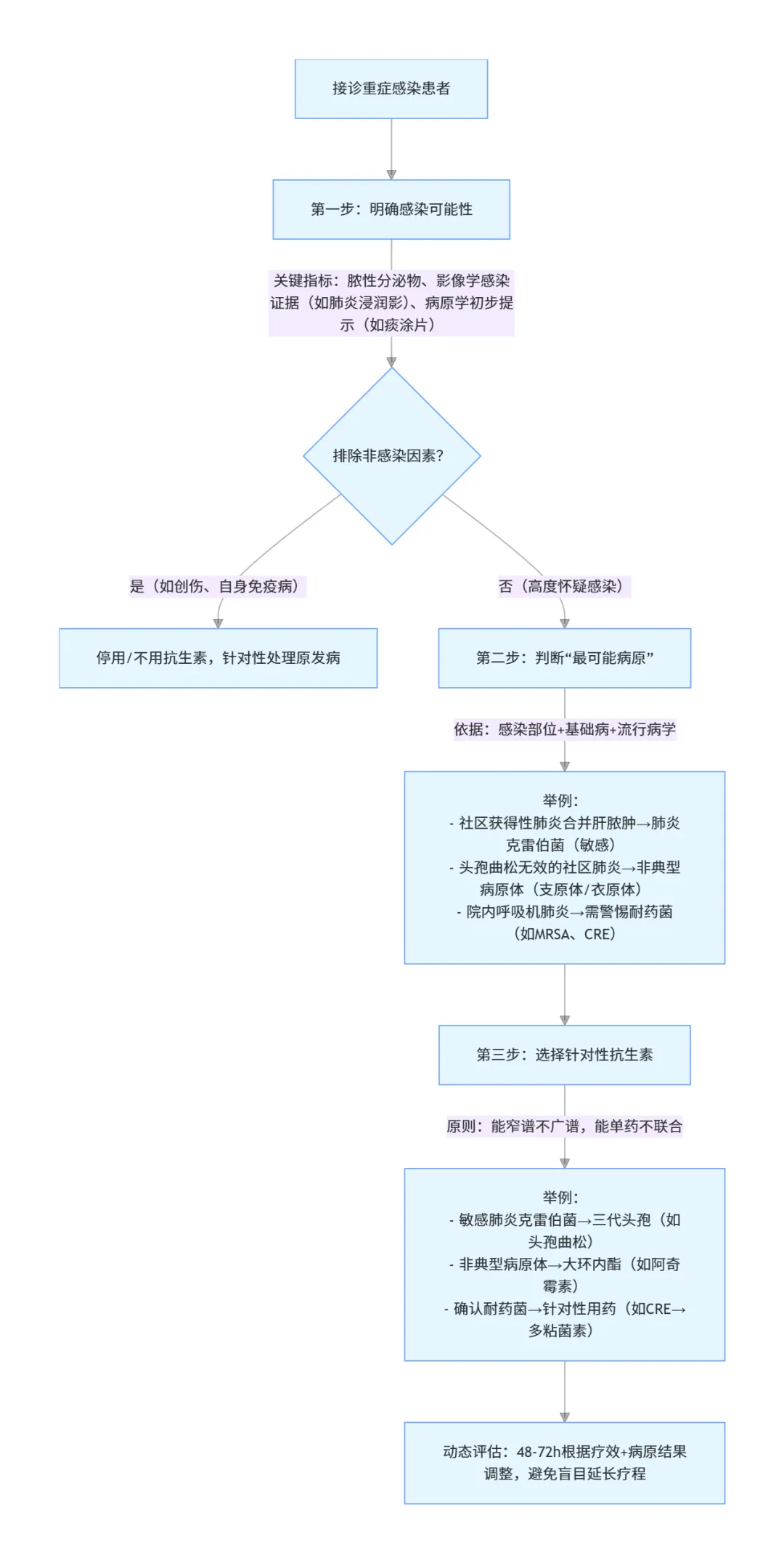
那回到最开始的两个病例:第一例是社区获得性肺炎合并肝脓肿,这样的病人不需要鉴别诊断,95% 是肺炎克雷伯菌,而且这时候的肺炎克雷伯菌通常对普通三代头孢菌素敏感,选择抗生素根本不是问题,不需要覆盖耐药阴性杆菌、耐药阳性球菌,更不可能是真菌。第二个病人是社区获得性肺炎,头孢曲松治疗五天无效,这时候只需要经验性覆盖非典型病原体,无论用大环内酯类还是呼吸道喹诺酮类就 ok 了 —— 中国指南、美国指南、英国指南都这样,没必要经验性覆盖耐药阴性菌、耐药阳性菌和真菌,除非你有足够多的证据说明是这些病原引起的。
所以我觉得,作为临床医生,我们有的时候把感染看得太简单了:总觉得这人是感染,病人病情一加重就觉得是感染引起的。我们想一想,有多少 ICU 的病人,你一边减呼吸机条件(说明呼吸功能在改善),一边说他出现了新的细菌性肺炎,还要使劲打‘肺里的致病微生物’—— 这其实是不对的!你有可能让一个重症肺炎病人同时呼吸功能逐渐改善吗?绝无可能!难道不是这样吗?刚才刘老师提的病例,肺里连浓痰都没有,用泰能和万古有什么用?泰能和万古打的不是化脓性细菌吗?如果病人连脓性气道分泌物都没有,凭什么是这俩药能治的病?这是不对的。
所以我自己的理解是:更多的时候我们需要思考,而不是‘培养出什么就治什么’,不是形成固定思路 —— 对所有人都是‘阴性杆菌 + 阳性球菌 + 厌氧菌 + 真菌’。如果所有感染病人都按这个思路治,医生的价值就没有了,不需要医生了。没有脓性气道分泌就打细菌、没有充分引流感染灶就使劲用抗生素解决问题,这些都是错误的概念。
其实我们更多时候把感染当做‘垃圾筐’:找不出其他原因,就说这人多半是感染;偏偏这时候上级大夫也很少提不同意见,因为他也是这么想的。所以为什么那些貌似正确的经验性抗生素策略,在临床研究中得不到验证?问题更多出在‘我们怎么诊断感染、怎么判断病原微生物’上。
我不要求一小时之内就把经验性抗生素用上 —— 那样的话,一定是用固定方案‘1+2+3’给所有病人用;宁可花更多时间了解病人的特征、临床表现,判断这个病人可能的病原微生物和其他病人有什么不一样,我的经验性抗生素应该覆盖哪一些、而不是其他病原,把时间花在这上面,才是正确的做法。
我想跟大家说的是:重症感染的诊断其实是有问题的,我们自己想一想就知道 —— 我们诊断了太多的感染,把太多不是感染的病人归为感染。抱歉的是,我很难给大家一个公式,说‘什么加什么等于感染’‘什么加什么等于某类感染’,这个很难。抗生素是双刃剑,刚才院长也提到了,所以抗生素不是什么时候都能用来治‘发烧加白细胞升高’的,谢谢大家。”
核心观点:重症感染抗生素治疗需摒弃 “全覆盖、重锤猛击” 的固定思维,聚焦 “最可能病原”,优先明确诊断而非盲目用药。
传统错误思维 | 正确认知(视频核心证据) | 支撑研究 / 案例 |
重症感染 = 耐药菌感染,需覆盖耐药阳球、阴杆、真菌 | 重症感染仅表示 “危及器官功能 / 生命”,与细菌耐药无必然联系 | 1. 美国 MRSA 研究:社区获得性 MRSA(敏感)毒力因子阳性率 75%,医院获得性 MRSA(耐药)仅 5%;2. 猪链球菌感染:病死率>60%,但对青霉素 100% 敏感 |
早期用广谱抗生素→降低病死率 | 盲目早期广谱用药可能升高病死率,等待微生物学证据再用药更安全 | 《柳叶刀》外科 ICU 研究:- 积极组(怀疑即用药):抗生素用得早,病死率高;- 保守组(证实后用药):延误 0.5-1 天,病死率低 |
广谱抗生素比窄谱更 “保险” | 广谱可能 “充分但不恰当”,甚至无效 | 1. 敏感金葡菌菌血症:万古霉素(广谱)比青霉素(窄谱)病死率高、失败率高;2. 社区获得性肺炎:美罗培南(广谱)无法覆盖非典型病原体,病死率增加 |
联合用药优于单药 | 无证据支持联合用药改善病死率 / 降低失败率 | 1. 德国 600 例重症感染研究:单药(美罗培南)vs 联合(美罗培南 + 莫西沙星),器官功能衰竭无差异;2. 2014 年研究:联合用药不改善重症感染病死率 |
降阶梯治疗(先广谱再减量)有效 | 降阶梯不降低病死率,反而增加耐药菌定植 / 二重感染 | 1. 韩国医院获得性肺炎研究:降阶梯组耐药菌出现率 38% vs 对照组 17%;2. 法国 120 例研究:降阶梯组抗生素疗程延长 1.5 天,二重感染率升高 |
发烧 + 白细胞升高 = 感染 | 住院病人中仅 25% 为感染,54% 诊断准确性≈抛硬币 | 加拿大 3 病例研究:病情越重,医生越倾向诊断感染、用广谱药,但病情重≠感染(如创伤休克) |
1. 《柳叶刀》外科 ICU 抗生素策略对比
指标 | 积极抗生素治疗组(怀疑即用药) | 保守抗生素治疗组(证实后用药) |
抗生素使用时间 | 更早(留培养后立即用) | 延误 0.5-1 天 |
病死率 | 更高 | 更低 |
非感染患者用药率 | 高(无效用药风险高) | 低(减少肠道菌群紊乱等危害) |
2. 社区vs医院获得性MRSA对比
类型 | 耐药性 | 毒力因子阳性率 | 临床启示 |
社区获得性 MRSA | 低(对更多抗生素敏感) | 75% | 毒力强≠耐药,勿盲目用万古霉素 |
医院获得性 MRSA | 高 | 5% | 耐药强≠毒力强,需结合感染证据 |
1.诊断优先于用药:无脓性分泌物、无明确感染证据时,不盲目启动广谱抗生素(避免 “垃圾筐” 思维);
2.病原 “抓重点”:放弃 “覆盖所有病原” 的幻想,聚焦 “最可能病原”(如社区肺炎先考虑敏感菌 + 非典型病原体);
3.抗生素是双刃剑:避免 “重锤猛击”,警惕耐药菌、二重感染、肠道菌群紊乱等危害,动态调整方案。