 n
n
阶段重点突破练(一)[分值:100分]
(选择题1~3题,5~7题,9~13题,每小题6分,共66分)
一、二氧化硫的性质及应用
1.(2024·广东清远高一段考)SO2是一种食品添加剂,在食品加工中起着重要的作用,但如果使用不当就有可能造成食品中SO2残留量超标。葡萄酒中添加适量的SO2能防止葡萄酒中的某些成分氧化变质,这是利用了SO2的( )
A.氧化性B.漂白性
C.还原性D.有毒性
答案 C
解析葡萄酒中添加适量的SO2能防止葡萄酒中的某些成分氧化变质,说明SO2具有还原性,故选C。
2.下列有关二氧化硫的说法错误的是( )
A.SO2通入Na2SO3或NaHCO3溶液均能发生反应
B.SO2能使滴有酚酞的NaOH溶液褪色是因为它的漂白性
C.用酒精灯加热已被SO2漂白的品红溶液,可恢复原来的红色
D.SO2和O2混合后在催化剂存在的条件下加热,可生成SO3
答案 B
解析 SO2+H2O+Na2SO3===2NaHSO3,SO2+NaHCO3===NaHSO3+CO2,A正确;二氧化硫具有漂白性,但不能漂白酸碱指示剂,SO2能使滴有酚酞的NaOH溶液褪色是因为它作为酸性氧化物与碱反应,B错误。
3.(2024·河北邯郸月考)某兴趣小组欲利用如图装置进行SO2气体的相关实验,其中能达到实验目的的是( )
A.图1:制备SO2
B.图2:验证SO2水溶液呈酸性
C.图3:验证SO2的漂白性
D.图4:吸收SO2尾气
答案 B
解析 Na2SO3固体与硫酸反应剧烈,且Na2SO3溶于水,不能用启普发生器,A错误;SO2+H2OH2SO3,可以用石蕊溶液检验SO2水溶液呈酸性,B正确;SO2能使酸性高锰酸钾溶液褪色,体现SO2的还原性,不能验证SO2的漂白性,C错误;澄清石灰水的浓度较低,不能用来吸收SO2,应该用NaOH溶液,D错误。
4.(12分)(2024·河北保定高一下月考)某化学兴趣小组对SO2与Na2O2的产物进行了探究。
同学们经过讨论,提出了如下猜想:
猜想1:产物为Na2SO3和O2
猜想2:产物为Na2SO4
甲同学设计如图所示实验装置(夹持装置已省略)制备SO2并进行实验探究,请回答下列问题:
(1)甲同学用带火星的木条检验出丁中收集的气体为氧气,该同学认为猜想1正确,乙同学分析装置后推翻了甲同学的结论,乙同学的理由可能是,
乙同学对实验装置进行了改进,在装置甲和装置乙之间添加了装置戊,装置戊可能是(填字母)。
(2)改进实验装置后,丙同学在乙处硬质玻璃管内淡黄色固体全部变成白色后,取适量反应后的白色固体a于试管ⅰ中,加入适量的稀硫酸,有气泡产生,将产生的气体通入适量酸性高锰酸钾溶液b中,溶液b褪色,说明固体a中含有(填化学式),溶液b褪色的离子方程式为;另取适量固体a于试管ⅱ中,加入足量的稀盐酸酸化,充分反应后,加入适量的BaCl2溶液,观察到有白色沉淀产生,该白色沉淀为(填化学式)。
实验结论:SO2与Na2O2在常温时就能发生化学反应,生成(填化学式)和O2。
答案 (1)生成的二氧化硫中混有水蒸气,水能与Na2O2反应产生O2 AB (2)Na2SO3 5SO2+2Mn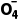 +2H2O===5S
+2H2O===5S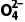 +2Mn2++4H+ BaSO4 Na2SO3、Na2SO4
+2Mn2++4H+ BaSO4 Na2SO3、Na2SO4
解析(1)生成的SO2中混有水蒸气,水能与Na2O2反应产生O2,故应该排除水的干扰,在装置甲、乙之间添加装置戊对SO2进行干燥,故装置戊可能是A、B装置。(2)将产生的气体通入适量酸性高锰酸钾溶液中,溶液褪色,可知生成的气体为SO2,则固体a中含有Na2SO3,Na2SO3和酸性高锰酸钾溶液发生氧化还原反应的离子方程式为5SO2+2 +2H2O===5
+2H2O===5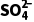 +2Mn2++4H+;另取适量固体a于试管ⅱ中,加入足量的稀盐酸酸化,充分反应后,加入适量的BaCl2溶液,观察到有白色沉淀产生,该白色沉淀为不溶于酸的硫酸钡沉淀;实验说明SO2与Na2O2在常温时反应生成Na2SO4、Na2SO3和氧气。
+2Mn2++4H+;另取适量固体a于试管ⅱ中,加入足量的稀盐酸酸化,充分反应后,加入适量的BaCl2溶液,观察到有白色沉淀产生,该白色沉淀为不溶于酸的硫酸钡沉淀;实验说明SO2与Na2O2在常温时反应生成Na2SO4、Na2SO3和氧气。
二、H2SO4的性质及应用
5.(2024·江苏连云港高一期中)下列关于浓硫酸性质的说法不正确的是( )
A.浓硫酸可使蔗糖脱水,具有脱水性
B.常温下,铁在浓硫酸中发生钝化
C.敞口放置一段时间后质量减轻
D.浓硫酸沸点高,难挥发,常温下比较稳定
答案 C
解析浓硫酸具有吸水性,敞口放置一段时间后质量增加,故选C。
6.(2024·广东清远高一段考)铝制器皿能够盛放的物质是( )
A.NaOH溶液B.浓硫酸
C.稀硫酸D.稀盐酸
答案 B
解析铝与NaOH溶液、稀硫酸、稀盐酸反应而不断溶解,不能用铝制器皿盛放;铝在浓硫酸中发生钝化,故铝制器皿可以盛放浓硫酸。
7.(2024·云南大理高一段考)下列对浓硫酸的叙述正确的是( )
A.常温下不能用铁制容器盛放浓硫酸,因为铁是活泼金属
B.浓硫酸和木炭加热反应,表现出强氧化性
C.因为浓硫酸是酸,具有酸的通性,因此可以用石蕊试纸检验
D.滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化
答案 B
解析常温下铁在浓硫酸中钝化,能用铁制容器盛放浓硫酸,A错误;由于浓硫酸具有脱水性,石蕊试纸遇浓硫酸会变黑,不能用石蕊试纸检验浓硫酸,C错误;滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,胆矾变为无水硫酸铜,有新物质生成,属于化学变化,D错误。
8.(10分)某同学在研究Fe与H2SO4的反应时,进行了如下实验。
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是。
(3)实验Ⅲ中,加热后产生大量气体,A试管中溶液的红色褪去,C处始终未检测到可燃性气体。B试管中发生反应的离子方程式是。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于。
②造成生成物多样性的主要因素有。
答案 (1)Fe+2H+===Fe2++H2↑ (2)铁丝表面生成致密的氧化膜,阻止反应进一步进行 (3)SO2+2OH-===S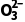 +H2O (4)①+1价的氢元素 ②反应物的浓度、温度
+H2O (4)①+1价的氢元素 ②反应物的浓度、温度
解析(3)实验Ⅲ中,铁与浓硫酸共热发生反应生成二氧化硫,实验中未检测到可燃性气体,说明反应中没有氢气生成,二氧化硫具有漂白性,能使品红溶液的红色褪去,二氧化硫是酸性氧化物,与足量氢氧化钠溶液反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-===S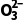 +H2O。
+H2O。
三、硫酸根离子的检验及应用
9.(2024·河北邯郸高一段考)下列关于物质或者离子检验的试剂(反应条件可以加热)说法错误的是( )
A.检验Na2SO3固体是否在空气中变质的试剂是盐酸和BaCl2溶液
B.检验纯碱固体中是否含有小苏打的试剂是澄清石灰水
C.检验氯气中是否含有HCl气体的试剂是稀HNO3和AgNO3溶液
D.检验CO2气体中是否混有SO2气体的试剂是品红溶液
答案 C
10.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是( )
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去Mg2+的反应的离子方程式为Mg2++2OH-===Mg(OH)2↓
答案 C
解析加入过量的氢氧化钠可以将镁离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,加入碳酸钠可以将钙离子转化为沉淀,但是加入碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3等,C错误。
四、含硫物质的性质及其相互转化
11.(2024·重庆高一段考)下列物质能使酸性高锰酸钾溶液褪色,且褪色原理相同的是( )
①活性炭 ②H2S溶液 ③SO2④稀硫酸 ⑤Na2SO3溶液
A.②③⑤B.②③④
C.①②④D.①③⑤
答案 A
解析①活性炭具有吸附性,可以使高锰酸钾溶液褪色;②H2S溶液、③SO2、⑤Na2SO3具有还原性,可与高锰酸钾发生氧化还原反应使其褪色;④稀硫酸不能使高锰酸钾溶液褪色。
12.(2024·河南周口月考)部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a的浓溶液与足量Cu加热反应后,剩余溶液加入碳酸氢钠溶液有气体放出
B.SO2通入紫色石蕊溶液先变红后褪色
C.b溶液在空气中久置后溶液变浑浊
D.d既可被氧化,也可被还原
答案 B
解析由图像可知,a为硫酸,b为H2S,c为硫单质,d为亚硫酸盐。浓硫酸变成稀硫酸,不再与铜反应,所以剩余溶液中还有硫酸,加入碳酸氢钠溶液有气体放出,A正确;SO2通入紫色石蕊溶液中,能变红,但不能褪色,B错误;氢硫酸在空气中久置会被氧化成硫单质,溶液会变浑浊,C正确;亚硫酸盐中S为+4价,既可被氧化,也可被还原,D正确。
13.(2023·河北衡水高一月考)硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如图:
下列说法正确的是( )
A.Na2S2O3作脱氯剂时主要利用其氧化性
B.“净化”时加入的试剂X可选用BaCl2溶液
C.“反应”过程中体系pH大小对产品产率无影响
D.提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤
答案 D
解析纸浆漂白时留下的含氯物质具有强氧化性,硫代硫酸钠作脱氯剂时,主要利用其还原性,A项错误;“净化”时加入的试剂X是为了除去硫酸根离子,加入BaCl2溶液会引入新杂质氯离子不易除去,可选用Ba(OH)2溶液,B项错误;若pH过小,Na2S2O3不稳定,会发生歧化反应,使产率降低,C项错误;从溶液中获得的Na2S2O3·5H2O晶体中含有杂质,应先水洗除去吸附的杂质离子,由于硫代硫酸钠晶体不溶于乙醇,再用乙醇洗涤除去水,D项正确。
14.(12分)某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:。
(2)设计实验,证明实现了该转化(写出操作和现象):。
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
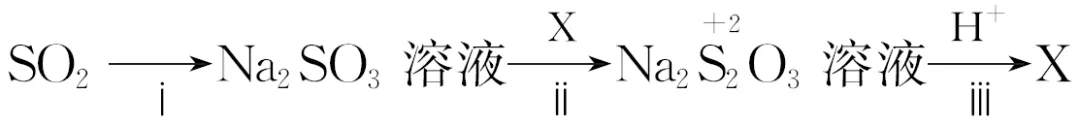
(3)ⅰ中加入的物质是,该转化说明SO2的类别是。
(4)写出ⅲ反应的离子方程式:。
答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2)将产生的气体通入品红溶液中,溶液褪色 (3)NaOH溶液 酸性氧化物 (4)2H++S2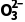 ===S↓+SO2↑+H2O
===S↓+SO2↑+H2O
解析(1)要实现S(+6价)→S(+4价)的转化,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu,反应的化学方程式为Cu+2H2SO4(浓)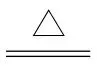 4+SO2↑+2H2O。(2)要证明实现了该转化只需要证明产生SO2,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化
4+SO2↑+2H2O。(2)要证明实现了该转化只需要证明产生SO2,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化

通过网盘分享的文件:【淘宝店:品优教学】赠送等3个文件
链接: https://pan.baidu.com/s/14JjMersl6LhQKtDB_Tv3Cw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享